الكيمياء العامةعناصر الجدول الدورى
معلومات هامة جداً عنصر الفوسفور Phosphorus

أولاً: ما هو عنصر الفوسفور؟ What is Phosphorus element
– التوزيع الإلكتروني له : 1S2 , 2S2 2P6 , 3S2 3P3
– هو عبارة عن عنصر لا فلز ، له عدة أشكال متأصلة أهمها الفوسفور الأبيض والفوسفور الأحمر.
– الفسفور الأبيض هو الصورة المعتادة للفوسفور، يوجد على هيئة مادة جامدة صفراء باهتة اللون، وهي لينة إلى حد ما عند تدفئتها، ولكنها تصبح هشة عند تبريدها.
– والفسفور الأبيض شديد السمية وتكفي جرعة صغيرة منه لإحداث الوفاة.
– الفسفور الأحمر فلا رائحة له، وهو غير سام، لذلك يعد الصورة المعتادة للفوسفور المستخدم في التفاعلات الكيميائية.

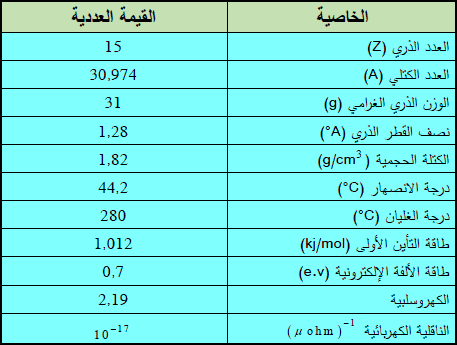
– الجدول التالي يوضح بعض الخواص العامة لهذا العنصر:
ثانياً: اكتشاف الفوسفور ووجوده في الطبيعة Discovery of Phosphorus
– اكتشف عام 1669م على يد الكيميائي (براند Brand).
– اشتق أسمه من اليونانية (Phos) وتعنى (ضوء) و (Phoros) وتعنى (حامل) بمعنى حامل الضوء إشارة إلى الفوسفور الأبيض الذي يضيء في الظلام بوجود الأكسجين.
– لشدة فعاليته لا يوجد بشكل حر في الطبيعة وانما يوجد على شكل أملاح حمض الفوسفوريك.
– وأهم فلزاته في الطبيعة فوسفات ثلاثية الكالسيوم Ca3(PO4)2 ويكون هذا الفلز ممزوجا أحيانا مع كلوريد أو فلوريد الكالسيوم ويدعى هذا المزيج بكلور أباتيت أو فلور أباتيت. كما يوجد على شكل هيدروكسي أباتيت وهي المادة الأساسية التي تدخل في تكوين عظام أسنان الحيوانات والانسان.
ثالثاً: تحضير عنصر الفوسفور Preparation of Phosphorus
– يتم الحصول على هذا العنصر بتسخين مزيج من فوسفات ثلاثية الكالسيوم Ca3(PO4)2 والسيليكا SiO2 والكربون في فرن كهربائي خاص تصل حرارته حتى 1500 °م. وتحدث في الفرن التفاعلات التالية:
(1) تتفاعل السيليكا مع فوسفات الكالسيوم معطية خماسي أكسيد الفسفور وسيليكات الكالسيوم الذي يؤخذ من فتحات جانبية:
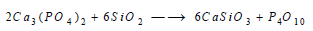
(2) يُختزل خماسي الفوسفور بالكربون إلى الفوسفور الحر:
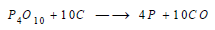
حيث تخرج أبخرة الفوسفور وأحادي أكسيد الكربون من فتحة من أعلى الفرن.
(3) يكثف بخار الفوسفور بتبريده في الماء ويجمع تحت سطح الماء لعزله عن الهواء لتجنب احتراقه.
– يحضر الفوسفور بتسخين سداسي أكسيد الفوسفور:
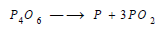
رابعاً: الخواص الكيميائية لعنصر الفوسفور Chemical properties of Phosphorus
(1) التفاعل مع الأكسجين Reaction between Phosphorus and Oxygen
يحترق بصورة عامة في الهواء متحولاً إلى خماسي أكسيد الفسفور P4O10 إذا كانت كمية الهواء وافرة، أو إلى ثلاثي أكسيد الفسفور P4O6 إذا كانت كمية الهواء قليلة.
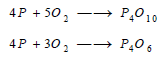
(2) التفاعل مع الماء Reaction between Phosphorus and water
يتفاعل مع الماء بعنف مشكلاً عدة حموض أهمها حمض الفوسفوريك:
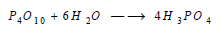
(3) التفاعل مع الكلور Reaction between Phosphorus and Chlorine
يتفاعل مع الكلور بسرعة مشكلاً ثلاثي أو خماسي كلوريد الفسفور:
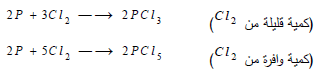
(4)تفاعل الفوسفور مع الكبريت Reaction between Phosphorus and Sulfur
يتفاعل مع الكبريت مشكلاً العديد من كبريتيدات الفسفور أهمها P4S3
(5) تفاعل الفوسفور مع المعادن Reaction between Phosphorus and Metals
يتحد بالحرارة مع العديد من المعادن مشكلاً فوسفيدات هذه المعادن مثل: Na3P , Mg3P2 , Ca3P2 وهذه المركبات تنحل بشدة في الماء محررة غاز الفوسفين وهيدروكسيد المعدن.
خامساً : استخدامات عنصر الفوسفور Uses of Phosphorus
(1) يحول 90 % من ناتج صناعة الفوسفور إلى حمض الفوسفوريك الذي يستعمل في الحصول على العديد من أملاح الفوسفات، كما يستعمل في إزالة عسرة المياه عن طريق التفاعل مع أملاح الكالسيوم الموجودة فيه.
(2) يدخل في بعض الخلائط المعدنية ويكسبها القوة والمتانة وعدم التأثر بالماء.
(3) يدخل في تركيب بعض المواد التي تعتمد على حادثة الفسفرة في إصدار الضوء والتي تستعمل في طلاء عقارب الساعات وجوانب الأرصفة والشارات الضوئية.
(4) يدخل في صناعة بعض المركبات السامة والتي تستعمل في القضاء على القوارض.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.