الكيمياءالكيمياء العامة
تحضير الأحماض والقواعد والأملاح Preparation of acids, bases and salts

(ِأ)- تحضير الأحماض Preparation of acids
نستطيع
ان نجمل تحضير الأحماض بأحد الطرق الآتية:
ان نجمل تحضير الأحماض بأحد الطرق الآتية:
1- الاتحاد
المباشر لعنصري الحمض
المباشر لعنصري الحمض
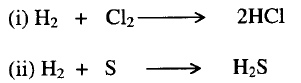
2-
تفاعل (إذابة) أكاسيد اللافلزات في الماء
تفاعل (إذابة) أكاسيد اللافلزات في الماء
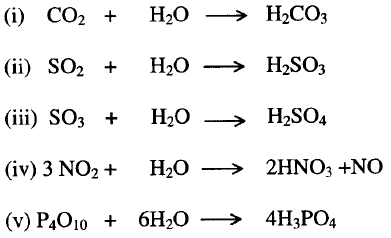
3- تسخين
أملاح الأحماض المتطايرة مع الاحماض الغير متطايرة
أملاح الأحماض المتطايرة مع الاحماض الغير متطايرة
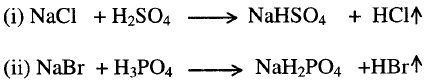
4- تفاعل
الأملاح مع الأحماض الأخرى منتجة رواسب
الأملاح مع الأحماض الأخرى منتجة رواسب
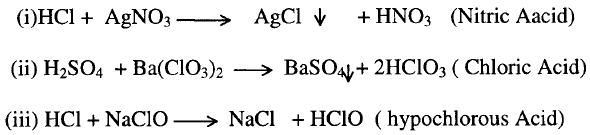
5- التميؤ
Hydrolysis
Hydrolysis
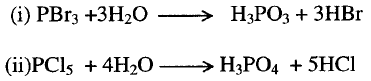
6-
الأكسدة والأختزال Redox reaction
الأكسدة والأختزال Redox reaction
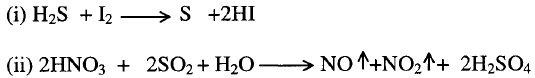
(ب)- تحضير القواعد
الهيدروكسيلية Preparation of bases
نستطيع
أن نجمل تحضير هذه القواعد بالطرق الآتية:
أن نجمل تحضير هذه القواعد بالطرق الآتية:
1- تفاعل
الفلزات الأرضية Alkaline earth
metals مع الماء
الفلزات الأرضية Alkaline earth
metals مع الماء
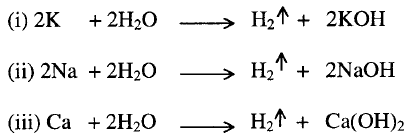
2-
تفاعل أكاسيد الفلزات مع الماء
تفاعل أكاسيد الفلزات مع الماء
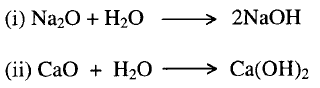
3-
تفاعل الأملاح مع القواعد الأخرى مكونة رواسب
تفاعل الأملاح مع القواعد الأخرى مكونة رواسب
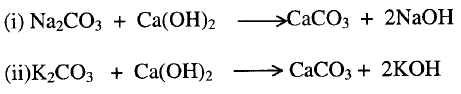
4-
التحليل الكهربائي Electrolysis
التحليل الكهربائي Electrolysis
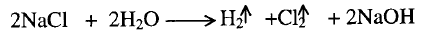
5- إذابة الأمونيا في
الماء
الماء
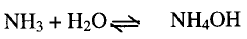
(ج)- تحضير الأملاح Preparation of salts
تعريف
الملح
الملح
هو مادة أيونية يمكن أن تختلف في صفاتها ماعدا أيونيتها ومذاقها يمكن أن يكون
ملحياً أو مالحاً (Salty) ، قارصاً (S
هو مادة أيونية يمكن أن تختلف في صفاتها ماعدا أيونيتها ومذاقها يمكن أن يكون
ملحياً أو مالحاً (Salty) ، قارصاً (S
our) ، مراً (Bitter) ، حلواً (Sweet) ، أو لا مذاق لها (Tasteless) ومحاليلها يمكن أن تكون
حمضياً أو قاعدياً أو متعادلاً وأيضاً مصورها أو محاليلها توصل التيار الكهربائي
وتتنوع أنواعها بين الأملاح العادية، الهيدروجينية، الهيدروكسيلية، الأكسجينية.
حمضياً أو قاعدياً أو متعادلاً وأيضاً مصورها أو محاليلها توصل التيار الكهربائي
وتتنوع أنواعها بين الأملاح العادية، الهيدروجينية، الهيدروكسيلية، الأكسجينية.
أنواع
الأملاح Types of salts
(1) الأملاح العادية Normal salts
وهي التي
لا تحتوي على ذرة (H) أو مجموعة (OH) وأمثلتها كلوريد الصوديوم
NaCl ، كبريتات البوتاسيوم K2SO4 ، فوسفات الكالسيوم Ca3(PO4)2
لا تحتوي على ذرة (H) أو مجموعة (OH) وأمثلتها كلوريد الصوديوم
NaCl ، كبريتات البوتاسيوم K2SO4 ، فوسفات الكالسيوم Ca3(PO4)2
(2) الأملاح الهيدروجينية Hydrogen salts
وتتكون
عندما يستبدل جزأياً هيدروجين الحامض بفلز وأمثلتها NaHCO3 ، Na2HPO4 ، NaHSO4 ، NaH2PO4
عندما يستبدل جزأياً هيدروجين الحامض بفلز وأمثلتها NaHCO3 ، Na2HPO4 ، NaHSO4 ، NaH2PO4
(3) الأملاح الهيدروكسيلية Hydroxy salts
وتتكون
عندما تستبدل جزءاً من مجموعات الهيدروكسيل لهيدروكسيد فلز أيوني ,امثلتها
هيدروكسي كلوريد الباريوم Ba(OH)Cl ، ثنائي هيدروكسيد كلوريد البزموت Bi(OH)2Cl
عندما تستبدل جزءاً من مجموعات الهيدروكسيل لهيدروكسيد فلز أيوني ,امثلتها
هيدروكسي كلوريد الباريوم Ba(OH)Cl ، ثنائي هيدروكسيد كلوريد البزموت Bi(OH)2Cl
(4) الأملاح الأكسجينية Oxysalts
وتتكون
عندما تفقد الأملاح الهيدروكسيلية جزئ من الماء وأمثلتها (BiOCl) بزموت أكسيد كلوريد أو أكسي كلوريد البزموت.
عندما تفقد الأملاح الهيدروكسيلية جزئ من الماء وأمثلتها (BiOCl) بزموت أكسيد كلوريد أو أكسي كلوريد البزموت.
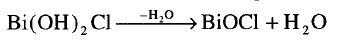
طرق تحضير
الأملاح Preparation of
salts
1- الاتحاد المباشر لعنصري
الملح
الملح
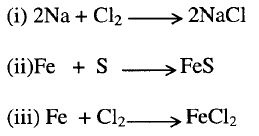
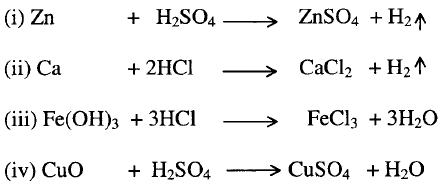
2-
تفاعل الأحماض مع الفلزات أو هيدروكسيد الفلزات أو أكاسيد الفلزات
تفاعل الأحماض مع الفلزات أو هيدروكسيد الفلزات أو أكاسيد الفلزات
3-
تفاعل انهيدريد الحمض مع انهيدريد القاعدة
تفاعل انهيدريد الحمض مع انهيدريد القاعدة
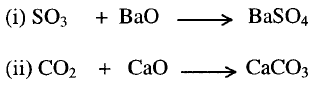
4-
تفاعل الأحماض مع الأملاح
تفاعل الأحماض مع الأملاح
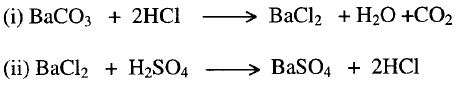
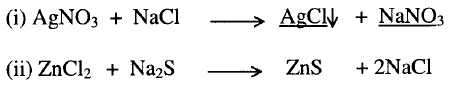
5-
تفاعل أملاح مع أملاح أخرى في المحاليل المائية لهذه الأملاح
تفاعل أملاح مع أملاح أخرى في المحاليل المائية لهذه الأملاح
المراجع: مبادئ الكيمياء العامة (نظري – مسائل محلولة) / محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش / الطبعة الثانية (2003) / شركة الجا للنشر العلمي – طرابلس.