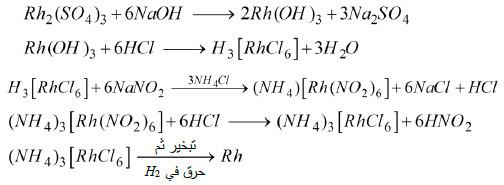الروديوم Rhodium – الخواص الفيزيائية والكيميائية للروديوم
محتويات الموضوع
ما هو عنصر الروديوم Rhodium؟
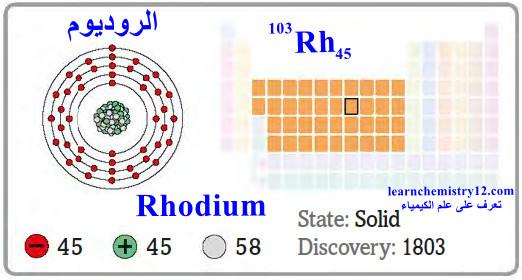
– الروديوم Rhodium هو عنصر من عناصر الجدول الدوري: العدد الذري = 45 ، العدد الكتلي = 103
– الرمز الكيميائي لعنصر الروديوم يرمز له بالرمز: 103Rh45
– التوزيع الإلكتروني له: Kr]36 5s1, 4d8]
– الروديوم فلز نادر لونه أبيض فضي
– مقاوم للتآكل وعاكس بشكل كبير.
– وهو من مجموعة البلاتين
– كما يتواجد في الطبيعة مختلطاً مع خام البلاتين الذي يعد من أغلى المعادن النفيسة على الإطلاق.
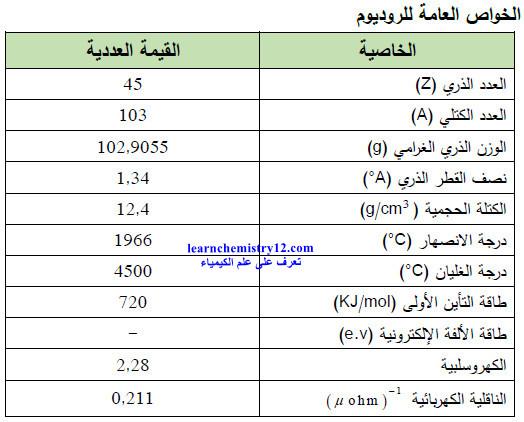
– الجدول التالي يوضح الخواص العامة لعنصر الروديوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Rhodium
– اكتشف من قبل Wollaston كيميائي بريطاني سنة 1804م.
– اشتق اسمه من اليونانية Rhodon بمعنى وردي لكون لون أملاحه وردية.
– الروديوم غير متفاعل ولا يشكل مركبات بسهولة. إنه معدن نادر.
– كما يعد عنصر (Rh) من المعادن النادرة إذ تبلغ 0.0001ppm من القشرة الأرضية.
– يتم استخراج معظم الشكل النقي لهذا العنصر عند استخراج البلاتين.
– ومن أهم خاماته Millerite خامات كبريتيد – نحاس – نيكل، وتحتوي على نسبة 0.1% من الروديـوم.
– الروديوم غير متفاعل ولا يشكل مركبات بسهولة. كما إنه معدن نادر.
طرق تحضير الروديوم Preparation of Rhodium
– يمكن الحصول على الروديوم انطلاقًا من معادن البلاتين وذلك بعد إذابة Au, Pd, Pt في الماء الملكي وإذابة Ag في صورة ملح نترات.
– وبعد ذلك تبقى مادة صلبة، يتم صهرها مع ملح NaHSO4 ثم يضاف إليها الماء لإذابة (Rh) في صورة Rh2(SO4)3 الذي نحصل منه على المعدن كما يلي:
الخواص الكيميائية لعنصر الروديوم Chemical properties of Rhodium
(1) التفاعل مع الأكسجين
– يتفاعل الروديوم مع الأكسجين بتسخين حتى درجة 600 مo كما بالتفاعل التالي:
2Rh + 3/2 O2 → Rh2O3
(2) التفاعل مع الهالوجينات
يمكن تقسيم هاليداته إلى مجموعتين رئيسية هما:
- فلوريدات RhFn حيث n > 4
- ثالث هاليد RhX3
– توجد الفلوريدات RhF6 في الحالة الصلبة، وتتميز بقابليتها للتطاير وعدم الثبات الحراري، ويمكن في تحضيرها مباشرة من المعدن بتفاعله مع غاز الفلور F2، ويؤدي التحلل الحراري لها إلى تكوين فلوريدات RhF5 كما يلي:
Rh + 3F2 → RhF6 → RhF5 + 1/2F2
– أما الهاليدات RhX3 فهي أكثر الهاليدات استقراراً ويمكن الحصول عليها في صورة لا مائية من تفاعل المعدن نفسه مع الهالوجين كما بالمعادلة التالية:
2Rh + 3X2 → 2RhX3
(3) تفاعلات أخرى
بالإضافة إلى ذلك فأن معدن (Rh) لا يتأثر بالأحماض، ولذا يتم استخلاصهما بصهر المعدن مع أحد الأملاح الصلبة.
استخدامات الروديوم Uses of Rhodium
(1) نظراً لندرة هذا العنصر (Rh) فإنّ استخداماته تكون محدودة، فمثلاً يستخدم عاملاً حافزاً في التفاعلات الحفزية.
(2) كما تستخدم معقدات (Rh) مع الفوسفين كعوامل حفازة في تفاعلات الهدرجة.
(3) الروديوم النقي صلب لذلك يستخدم لتقوية المجوهرات والمرايا والأجهزة البصرية، مثل الميكروسكوبات ويمكنه مقاومة التآكل.
(4) علاوة على ذلك فأنه يستخدم بشكل رئيسي في إنتاج المحولات الحفازة للسيارات.
(5) الألياف الزجاجية، التي توجد غالبًا في أدوات الوقاية الشخصية – مثل الخوذات – تحتوي أيضًا على الروديوم حيث يتم تصنيع خيوط الألياف الزجاجية هذه عن طريق تمرير الزجاج المنصهر عبر صواني غنية بالروديـوم.
(6) بالإضافة إلى ذلك فأن طلاء (Rh) يمنع المجوهرات من فقدان لمعانها.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.