كتابة المعادلة الكيميائية Chemical Equation وكيفية وزنها
المعادلة الكيميائية Chemical Equation
المعادلة الكيميائية هي صورة توضح المواد الداخلة فى التفاعل الكيميائي والمواد الناتجة من هذا التفاعل والتغير الذي يصاحب هذا التفاعل من حيث عدد المولات ويفصل بينهما سهم كما هو موضح فى المثال التالي وعادة ما تكتب المواد المتفاعلة من الجهة اليسرى والناتجة من الجهة اليمني وتقرأ المعادلة من اليسار إلى اليمين
المواد الناتجة → المواد المتفاعلة
Reactants → Products
** من أهم خواص المعادلة الكيميائية أنها تمكنا من إيجاد العلاقات الكمية بين المواد المتفاعلة والمواد الناتجة من التفاعل، ولإجراء الحساب الكيميائي المطلوب يشترط أن تكون المعادلة الكيميائية موزونة أي تخضع لقانون حفظ الكتلة.خطوات كتابة المعادلة الكيميائية
(1) تكتب المواد المتفاعلة والمواد الناتجة لفظاً ويفصل بينهما سهم ومثلاً لتفاعل الألومنيوم مع الأكسجين لتكوين أكسيد الألومنيوم .
أكسيد الألومنيوم → أكسجين + الألومنيوم
(2) تكتب المعادلة بالرموز والصيغ للمواد المتفاعلة والناتجة (معادلة غير موزونة)
Al + O2 → Al2O3
(3) توزن المعادلة وذلك بوضع معاملات بجوار المواد الداخلة والناتجة بحيث كما ذكرنا يكون عدد الذرات لعنصر ما متساوية عددياً في كلا الطرفين. (معادلة موزونة)
4Al + 3O2 → 2Al2O3
أنواع التفاعلات الكيميائية وكيفية كتابة المعادلات الكيميائية
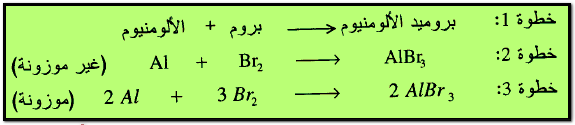
(أ) تفاعلات الاتحاد المباشر Direct Combination Reaction
وهو عبارة عن تفاعل عنصرين لتكوين مركب وكمثال على ذلك معادلة اتحاد الألومنيوم مع البروم لتكوين بروميد الألومنيوم.
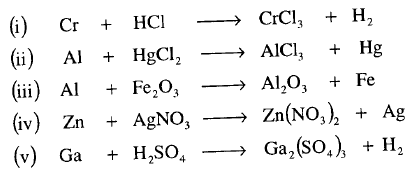
مثال: أوزن المعادلات التالية :
الحل:
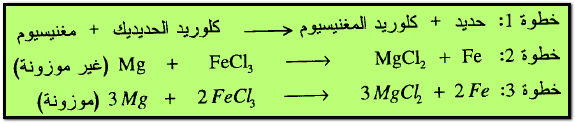
(ب) تفاعلات الإحلال البسيط Single Displacement Reaction
وهو عبارة عن تفاعل عنصر مع مركب لتكوين عنصر ومركب جديدين ، كمثال على ذلك تفاعل المغنسيوم مع كلوريد الحديديك فنتاج كلوريد المغنسيوم والحديد.
مثال: أوزن المعادلات التالية :
الحل:
(جـ) تفاعلات الإحلال المزدوج (الترسيب) Double Displacement Reaction
في هذا النوع من التفاعلات يتفاعل مركبان مع بعضهما لإنتاج مركبين جديدين بواسطة تبادل العناصر مع بعضهما البعض أو مجموعة أيونية، وكمثال على هذا النوع من التفاعل تفاعل نترات الفضة مع كلوريد الكالسيوم لإنتاج كلوريد الفضة ونترات الكالسيوم.
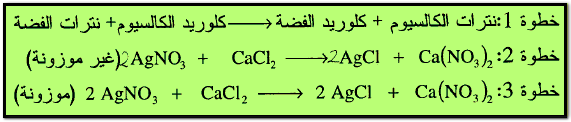
مثال: أوزن المعادلات التالية :
الحل:
نلاحظ من خلال المعادلات التي تم كتابتها بأنها توضع معاملات فقط بجوار الرموز والصيغ الكيميائية للعناصر والمركبات حسب الأحوال ولا يمكن تغيير أي رقم مكتوب أسفل الرموز لأن ذلك يغير من طبيعة المواد.
وزن المعادلة الكيميائية وكيفية كتابة المعادلة الكيميائية بعد وزنها
– عند موازنة المعادلة الكيميائية غيٌر في أمثال الجزئيات دون أن تُغير في نسب الذرات المكونة للصيغة الكيميائية في الجزيء الواحد، بحيث يكون عدد الذرات فى الجزء الأيسر مساوياً لعدد المرات فى الجزء الأيمن وهذا يحقق العلاقة:
كتلة المواد الداخلة في التفاعل = كتلة المواد الناتجة من التفاعل
– كقاعدة عامة وازن كل الذرات وأترك الأكسجين للأخير فهو يضبط عملية الموازنة، أي عند وزن معادلات احتراق الهيدروكربونات مع الأكسجين نزن الكربون (C) أولاً ثم الهيدروجين وترك الأكسجين للآخر لكي تتم وزن المعادلة نهائياً.
مثال: لديك المعادلات التالية التي تصف التفاعل الجاري بين المواد المتفاعلة (على يسار السهم) والمواد الناتجة (على يمين السهم)
لاحظ: أنه عند كتابة معادلة التفاعل فإننا نضع صيغ ورموز الذرات أو الجزئيات الداخلة فى التفاعل والناتجة عنه. ثم ننتقل بعد ذلك إلى موازنة المعادلة الكيميائية بحيث يكون عدد الذرات متساوياً في الطرفين. ثم نبحث عن الأعداد أو الأمثال التي يتوجب وضعها بجانب الصيغة دون أن نمس أمثال الصيغة الكيميائية ذاتها.

قانون بقاء الكتلة Law of Conversation of Mass
– تعني أن كتلة المواد الداخلة فى التفاعل تساوي كتلة المادة الناتجة عنه، تخيل أن المواد الداخلة تمثل إحدى كفتى ميزان وأن المواد الناتجة تمثل الكفة الثانية وفي المعادلة الموزونة فإن الكفتين متعادلتان بالكتلة.
– لاحظ أيضاً أن عدد مولات المواد الداخلة فى التفاعل قد يساوي أو لا يساوي عدد المولات الناتجة عن التفاعل.
– إذا كان ناتج التفاعل مادة واحدة فتكون كتلته تساوي مجموع كتل المواد المتفاعلة.
قانون النسب الثابتة Law of Definite Proportions
يعنى قانون النسب الثابتة أنه في أي مركب كيميائي نقى يجب ان يتكون من نفس عناصره (وبنسبة محددة مهما كان مصدره أو طريقة تحضيره) وبنسبة ثابتة ومحددة وتكون هذه النسبة بسيطة.
مثال: الماء وفوق أكسيد الهيدروجين يتكون كل منهما من نفس العناصر (O,H) ولكن بنسبة محددة لكل منهما فهي بالنسبة للماء H2O تكون (8:1) وبالنسبة لفوق أكسيد الهيدروجين H2O2 تكون (16:1).
قانون النسب المتضاعفة Law of Multiple Proportion
إذا اتحد عنصران وكونا أكثر من مركب فإن الأوزان المختلفة من أحدهما والتي تتحد مع وزن ثابت من الآخر ، لابد وأن تكون نسباً بسيطة أو مساوية لرقم صحيح 1:2 أو 1:2:3:4:5
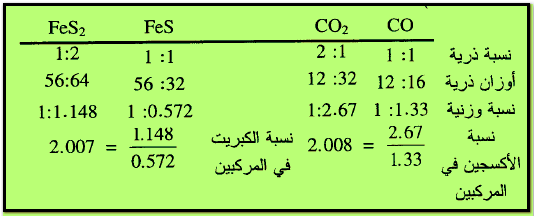
مثال (1): يتحد الكربون مع الأكسجين وفقاً لكمية الأكسجين
المتاحة ويكون الاحتراق تاماً أو جزئياً فيؤدى ذلك إلى تشكل CO2 أو CO ومثله (FeS,FeS2)
وفقاً لمنطوق القانون نجد أن نسبة كتلة الأكسجين المختلفة التى تتحد بكتله ثابته من الكربون في المركبين هي: 1/2 = 16/32 أو 1:2 ونلاحظ كذلك نسبة الكبريت المختلفة التي تتحد مع كتلة ثابتة من الحديد في المركبين هي 32/64 أو 1:2
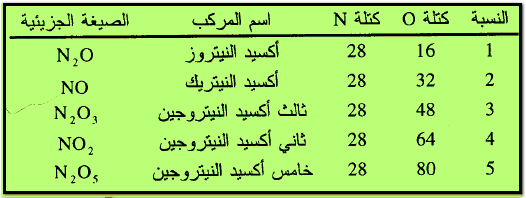
مثال (2): يتحد النيتروجين مع الأكسجين مكوناً خمسة مركبات مختلفة وفقاً لكمية كل من الأكسجين والنيتروجين وشروط التفاعل
وبتوحيد كمية أحد العنصرين ولتكن النيتروجين 28جم فأننا نجد إن الكميات المختلفة من الأكسجين والتي تتحد مع كمية ثابتة من النيتروجين (28جم) تكون نسبة عددية بسيطة هي 1:2:3:4:5
مسائل محلولة على كتابة المعادلة الكيميائية
(1) تنتج الأمونيا NH3 من اتحاد عنصري الهيدروجين والنيتروجين ، هل تعتبر المعادلة التالية مقبولة لتمثيل التفاعل المذكور؟3H2 + N → 2NH3
الحل: النيتروجين يتواجد في الهواء بشكل جزئ N2 وهكذا يدخل في التفاعل لذلك يجب أن تكون العادلة على الشكل التالي:3H2 + N2 → 2NH3
(2) اكتب المعادلات الموزونة للتفاعلات التالية، آخذاً فى الحسبان أن صيغة العناصر تكتب كما يلى:
Na , Cl2 , H2 , O2 , N2
(a) تفاعل الصوديوم مع الأكسجين لتشكيل كلوريد الصوديوم.
(b) وتفاعل الهيدروجين مع الأكسجين لتشكيل الماء.
(c) تفاعل النيتروجين مع الهيدروجين لتشكيل لتشكل مول واحد من الأمونيا.
(d)تفاعل الهيدروجين مع الكلور لتشكيل كلوريد الهيدروجين.
الحل:
المراجع
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.


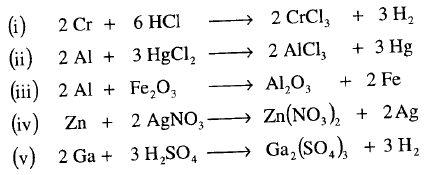
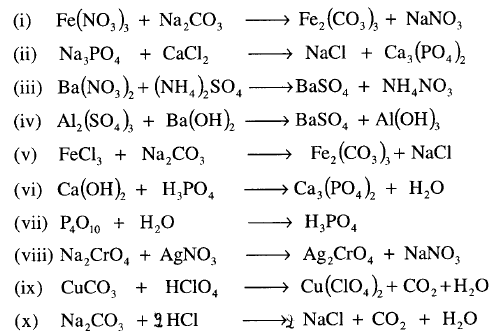
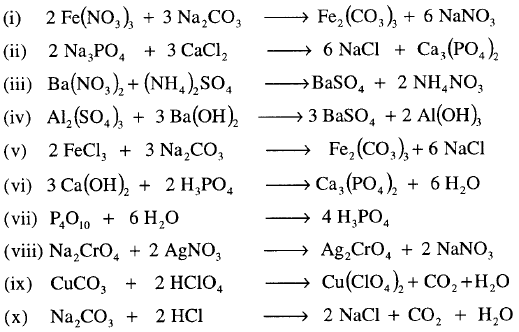
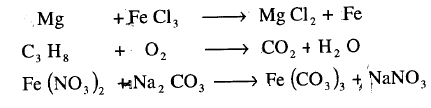
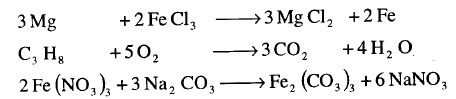
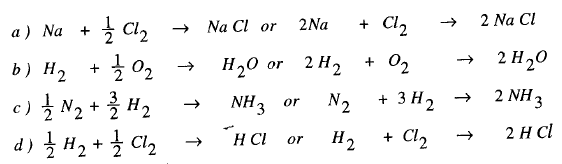




ممكن كتاب كيمياء الموادpdf
من هو مؤلف الكتاب وهل هو باللغة العربية ام الانجليزية
شكرا
اهلا وسهلا بك فى موقعنا
عفوا
عفوا
عاوزين سبب ان المعادله تمشي بالاحلال او الاتحاد المباشر الاسباب بس يعني او اشوف كتاب ايه
السلام عليكم
جزاكم الله خيرا على هذا العمل
ولكنكم ذكرتم قانون بقاء الطاقة والصحيح ( قانون بقاء الكتلة )
شكراُ لك …. تم التعديل
C1²+S²O²-³:C1+SO²-⁴
اربد حلها
ضع سؤالك على موقع / اسألني كيمياء فهو تابع لنا ask-chemistry.com
شكرا لكم المعلومات ربنا يحفظكم
شكراااا اعنتوني كثيراً
مقالة رائعة شكراً جزيلاً