الهيدروجين Hydrogen – الخواص الكيميائية والفيزيائية له

الخواص الفيزيائية للهيدروجين Physical properties of hydrogen
– للهيدروجين صفات فيزيائية وكيميائية استثنائية وفريدة في حد ذاتها. ويعزي ذلك إلى الترتيب الإلكتروني لحالته المستقرة أولاً وكونه أخف العناصر المعروفة.
– وحسب مفهوم لويس يمكن الحصول من تركيب الحالة المستقرة (1S1) على ترتيبات الكترونية مستقرة أخرى أما عن طريق المشاركة أو اكتساب إلكترون أخر.
– وبالإضافة إلى ذلك فإن البروتون +H المشتق من إزالة إلكترون ذرة الهيدروجين التكافؤي هو مثال آخر للعينات المدروسة جيداً.
– أن أبسط الاعتبارات التكافؤية تدل على إمكانية ذرة الهيدروجين على تكون مركبات تحتوي على رابطة تساهمية أحادية ومركبات أخري تحتوي على الهيدروجين بصورته الأيونية. ومن هنا يتعامل الهيدروجين بصورة مستقلة وفضل تصنيفه في مكان مستقل في الجدول الدوري.
(1) مميزات الهيدروجين
- غاز قليل الكثافة.
- عديم اللون والطعم والرائحة.
- لا يساعد على التنفس أو الاحتراق ولكن يشتعل في الهواء بلهب أزرق غير مضئ مكوناً الماء.
- وهو عديم الذوبان فيه.
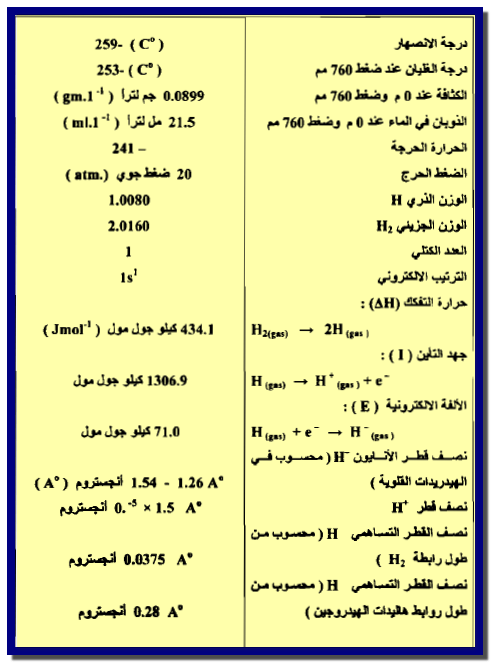
وأهم صفاته مبينة فى الجدول التالي كما يلي:
(2) يظهر الهيدروجين تشابها ً ملحوظاً مع عناصر ثلاث مجموعات فى الجدول الدوري
(أ) الهالوجينات:
يشبه الهيدروجين الهالوجينات من حيث قابليته على اكتساب إلكترون واحد مكوناً أيون الهيدريد –H
(ب) الفلزات القلوية:
يشبه الهيدروجين الفلزات القلوية إذ بإمكانه وتحت ظروف خاصة فقدان إلكترونه الوحيد مكوناً البروتون +H
(جـ) مجموعة الكربون:
– يشبه الهيدروجين إلى درجة ما عناصر مجموعة الكربون. إذ أنه يملك غلاف تكافؤي نصف مملوء يسهل علية تكوين روابط تساهمية ذات مدى واسع من القطبية.
– وهذه الصفة تنطبق فقط في حالة مقارنته مع الكربون الحاوي على غلاف تكافؤي واحد وحر (غير مشغول) كما في –H3C
(3) الأورثو – بارا هيدروجين Ortho and Para hydrogen
– لجزئية الهيدروجين صفة فيزيائية أخرى جديرة بالاهتمام هي الأورثو- والبارا هيدروجين.
– وكما هو الحال في جميع الجزئيات الثنائية الذرة والتي تمتلك نواياتها صفة البرم نجد أن جزئية الهيدروجين تظهر ما يسمى بأيزومرزم البرم Spin Isomerism.
– وهذا ناتج من احتمالية ظهور برم النواتين بصورتين مختلفتين معتمداً على الاتجاه. فعندما يكون البرم النووي للنواتين بنفس الاتجاه (متوازيين). وعلى سبيل المثال أما كلاهما باتجاة عقرب الساعة أو عكسه يطلق علية بالأيزومر أورثو Ortho-hydrogen وفي حالة كون برم النواتين باتجاهين متعاكسين كان يكون أحدهما باتجاه عقرب الساعة والآخر عكسه يعرف بالأيزومر بارا Para-hydrogen.
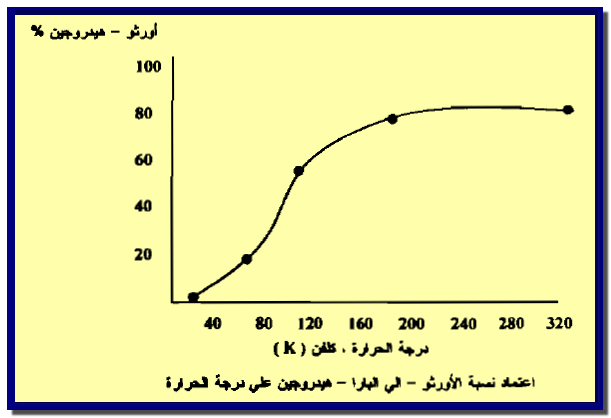
– غاز الهيدروجين عبارة عن مزيج متزن من الأورثو- والبارا هيدروجين كما فى الشكل التالي كما يلي:
– يتبين من الشكل يكون الأيزومر بارا- هيدروجين أكثر استقراراً في درجات الحرارة المنخفضة إذ تبلغ نسبته حوالي 100% عند الصفر المطلق.
– وبارتفاع درجة الحرارة تزداد نسبة اتزان الأورثو- هيدروجين حتى تصل إلى حوالي 75%عند درجة حرارة الغرفة.
– كما أن التحول من إيزومر إلى آخر بطئ ولكن يمكن تحفيزه باستعمال العديد من المواد المحفزة مثل الهيدروجين الذري أو المواد البارامغناطيسية مثل O2 ، NO ومركبات العناصر الانتقالية وتزداد نسبة التحول بازدياد صفة البارامغناطيسية للعامل الحفاز.
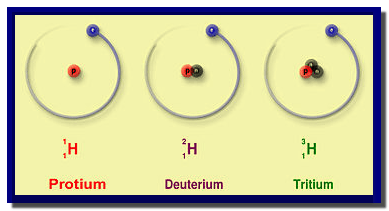
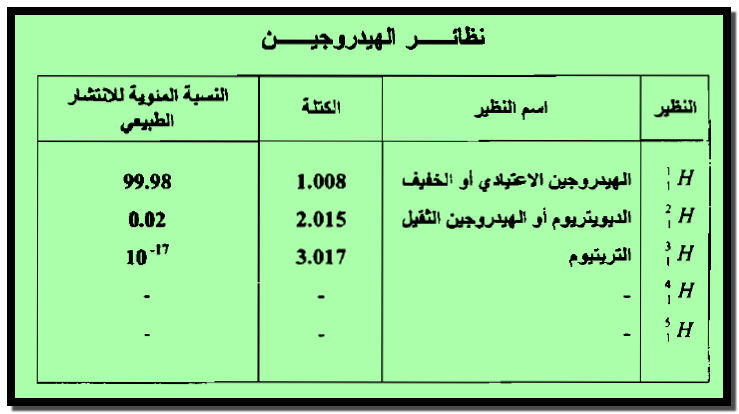
(4) نظائر الهيدروجين Hydrogen Isotopes
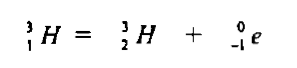
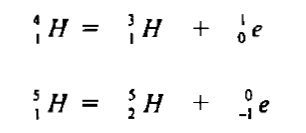
الخواص الكيميائية للهيدروجين Chemical properties of Hydrogen
– بالرغم من عدم فعالية الهيدروجين إلا أنه يحترق في الهواء مكوناً الماء.
– ويتفاعل مع معظم اللافلزات في ظروف متباينة كما هي موضحة في التفاعلات الآتية كما يلي:
(1) الأحتراق
– يحترق الهيدروجين في جو من الأكسجين كما بالمعادلة الآتية:
2H2 + O2 → 2H2O
(2) التفاعل مع الهالوجينات
– إن التفاعل مع الفلور يكون مصحوباً بانفجار، وأما في حالة الكلور فيكون مصحوباً باشتعال، أما في حالتي البروم واليود فأن التفاعل عكسي. وتكون الصيغة العامة للتفاعل كما يلي:
H2 + X2 → 2HX [ X = F,Cl,Br,I ]
(3) التفاعل مع الكبريت
– يحترق الكبريت في جو من الهيـدروجين كما بالمعادلة الآتية:
H2 + S → H2S
(4) التفاعل مع النيتروجين
– يحدث هذا التفاعل عند درجة حرارة 500 Co ، 200 ضغط جوي وفي وجود الحديد عاملاً حفازاً كما بالمعادلة الآتية:
3H2 + N2 → 2NH3
(5) التفاعل مع الفلزات الكهروموجبة
– يتحد الهيدروجين مع الفلزات الكهروموجبة وتحت ظروف معينة مكوناً هيدريدات.
– فمثلاً يحضر هيدريد الصوديوم صناعياً من تمرير غاز الهيـدروجين النقي على مصهور معدن الصوديوم عند درجات حرارة بين 250 – 300 Co
H2 + Na → NaH½
(6) القدرة على الاختزال
– إذ يختزل العديد من الأكاسيد بدرجات الحرارة العالية محولاً إياها أما إلى أكاسيدها الأقل (بالنسبة إلى تكافؤ الفلز) أو إلى الفلز نفسه.
– وبوجود عوامل حفازة مثل البلاتين أو أكسيد البلاتين يكون الهيـدروجين قادراً على اختزال الكثير من المركبات العضوية (في محاليل مذيبات عضوية معينة مثل الكحول أو حامض الخليك).
– فمثلاً يختزل المركبات غير المشبعة ، عن طريق الإضافة، فيحولها إلى مركبات مشبعة.
– بالإضافة إلى ذلك فأنه له القدرة على اختزال الألدهيدات إلى كحولات أولية ومركبات نيتروجينة محدودة إلى الأمونيا أو الأمينات كما فى المعادلات الآتية:
CnH2n + H2 → CnH2n+2
RCHO + H2 → RCH2OH
N2O + 3H2 → N2H4 + H2O
(7) تفكك الهيدروجين Dissociation of hydrogen
– تتطلب عملية تفكك الهيدروجين H2 إلى حرارة عالية جداً (تقريباً 2000 Co). وهذا يعتبر تفسيراً جزئياً لعدم فعاليته في درجات الحرارة العادية كما بالمعادلة الآتية:
H2 → 2H ΔH= 434.1 KJmol-1
– وفي الحالة الغازية وتحت ضغط معين فإن إعادة تكون الهيـدروجين الجزيئي (كما في المعادلة السابقة) عملية بطيئة نسبياً فمثلاً لذرات الهيدروجين تحت ضغط 0.2 م.زئبق عمر نصف زمني قدرة ثانية واحدة.
– ولكن في حالة وجود غاز غير فعال وتحت ضغط عالي أو في وجود فلزات معينة مثل البلاتين أو البلاديوم أو التنجستن يكون مثل هذا الاتحاد (إعادة تكوين الهيـدروجين الجزيئي) سريعاً جداً نظراً لأن الحرارة المتحررة من تكوين جزيئة H2 يمكن إزالتها من وسط التفاعل.
– تتم عملية تفكيك الهيـدروجين في أنابين التفريغ ذات الضغط المنخفض وبفعل الأقواس الكهربائية أو قصفه بإلكترونات ذات مدى طاقي 10-20 إلكترون فولت أو بالأشعة فوق البنفسجية.
– ويمكن تحرير الهيـدروجين الذري فى المحلول أيضاً أما بتعريض مذيبات معينة حاوية على الهيـدروجين إلى إشعاع مؤين أو بتحليل النايولات ضوئياً كما بالمعادلة الآتية:
.RSH → RS. + H
(8) الروابط الهيدروجينية
نظراً لأن موضوع الروابط الهيدروجينية لا يمكن تناوله باختصار فقد تم كتابة موضوع بالكامل عن الروابط الهيدروجينية. ويمكن قرأته من هنا : الروابط الهيدروجينية
المراجع – أسس الكيمياء غير العضوية .محمد مجدي واصل ، الطبعة لأولى / دار الفجر للنشر والتوزيع – القاهرة – جمهورية مصر العربية





عند خلط الفحم المنشط مع الماء هل يطلق غاز الهيدروجين؟