الزئبق Mercury – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الزئبق Mercury؟
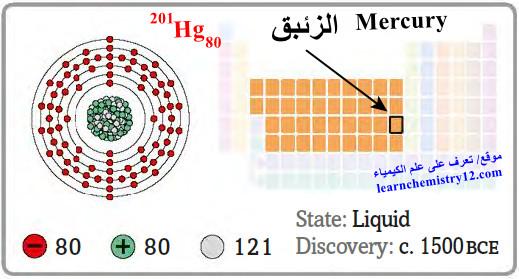
– الزئبق Mercury هو عنصر من عناصر الجدول الدوري: العدد الذري = 80 ، العدد الكتلي = 201
– الرمز الكيميائي لعنصر الزئبق يرمز له بالرمز: 201Hg80
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d10]
– الزئبق فلز ذو لون أبيض لامع مائل إلى الفضي.
– يكون سائلاً في درجة حرارة الغرفة، وإذا تم تسخينه ينتشر في الجو على شكل غاز عديم الرائحة واللون.
– الزئبق هو المعدن الوحيد الذي يكون سائلاً في درجة حرارة الغرفة.
– علاوة على ذلك فأن الزئبـق الصلب ناعم بما يكفي لقطعه بسكين.
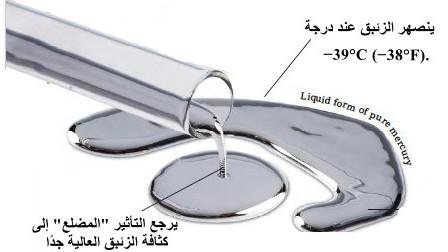
– يرجع التأثير (المضلع) إلى كثافة الزئبـق العالية جدًا كما بالصورة السابقة.
– كما يذوب هذا المعدن عند -39 درجة مئوية (-38 درجة فهرنهايت).
– هذا المعدن سام للغاية ويمكن أن يلحق الضرر بالأعضاء والأعصاب إذا تم استنشاقه أو ابتلاعه. ونتيجة لذلك، يتم مراقبة استخدام هذا المعدن بعناية اليوم.
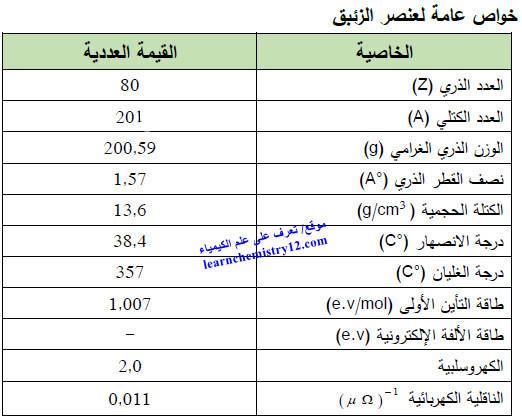
– الجدول التالي يوضح الخواص العامة لعنصر الزئبق كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Mercury
– عرف الزئبـق منذ أربعة آلاف سنة تقريبا في كل من الصين والهند، وبعد ذلك تم التعرف عليه في الاكتشافات الأثرية بمصر والتي تعود إلى سنة 1500 ق.م.
– تقع أكبر ترسبات الزئبـق في كل من إسبانيا والجزائر.
– يتشكل الزئبـق النقي حول البراكين حيث تفصله الحرارة عن معادنه مثل الزنجفر Cinnabar.
– تم استخدام هذا المعدن الأحمر لعدة قرون قام الرومان القدماء بتحميص الزنجفر لإطلاق سائل أطلقوا عليه اسم hydrargyrum، ويعني (الماء الفضي). وكان هذا عنصر الزئبـق، عُرف فيما بعد باسم الزئبق بسبب سرعة تدفقه كتيار من السائل.
تحضير الزئبق Preparation of Mercury
(1) يحضر الزئبق بواسطة تسخين كبريتيد الزئبق (HgS) في الهواء وثم تكثيف البخار الناتج، كما بالتفاعل التالي:
HgS + O2 → Hg + SO2
(2) يمكن الكشف عن الزئبـق بتسخين المادة المشتبه في احتوائها على الزئبـق باستعمال كربونات الصوديوم اللامائية في وعاء زجاجي صغير وفي حالة احتواء تلك المادة على الزئبـق فإنه يتكثف على شكل قطرات كروية.
الخواص الكيميائية لعنصر الزئبق Chemical properties of Mercury
– الزئبق لا يتفكك ولا يمكن إتلافه، يتحد مع عناصر أخرى ليشكل مركبات زئبقية لا عضوية يكون بعضها ذائباً في الماء.
– كما يتحد مع الكربون ليؤلف مركبات عضوية مثل: ميثيل الزئبـق.
(1) مركبات الزئبق Mercury Compounds
– تتميز مركبات الزئبق (+1) التي تمت دراستها حتى الآن باحتوائها على ذرتين من الزئبـق مرتبطتين ببعضها حيث تكون الصيغة العامة لهذه المركبات من الشكل (Hg2A2 ) عوضاً عن الصيغة البسيطة (HgA).
– وقد دلت الدراسات على أن محاليل الزئبـق (+1) تحتوي على هذا العنصر على شكل أيونات ثنائية الذرة (Hg+2).
– دلت الدراسات بالأشعة السينية أن البنية البلورية للعديد من أملاح الزئبـق (+1) تحتوي على الأيونات +Hg2 حيث يكون طول الرابطة (Hg – Hg) ثابتاً بغض النظر عن نوعية الأيون السالب المرتبط به، وبالفعل فإن مركبات الزئبـق (+2) جميعها تتميز بمغناطيسية عكسية، الأمر الذي يدل على أنها لا تحتوي على إلكترونات مفردة بينما يحتوي الأيون +Hg على إلكترون مفرد، مما يعطيه صفة المغناطيسية الطردية.
– يشكل الزئبق هالوجينات توافق الصيغتين Hg2X2 أو HgX2
– من المركبات الشائعة للزئبـق كما يلي:
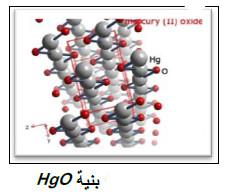
(أ) أكسيد الزئبق HgO
– لهذا الأكسيد لونان أصفر أو أحمر حسب حجم دقائقه الأصفر الذي حجم دقائقه أصغر
– أقل ذوبانية في الماء من HgO الأحمر.
– يحضر بعدة طرق، كالتفاعل المباشر بين الزئبـق والأكسجين في درجة حرارة تفوق 300 أو بإضافة أيون OH– لمحاليل +Hg2 في الماء.
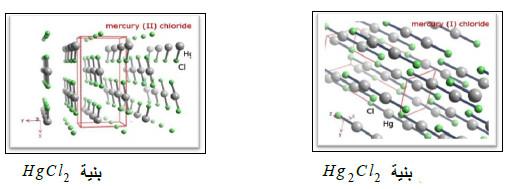
(ب) كلوريد الزئبق (الكالوميل) Hg2Cl2
– يعد الكالوميل من أهم هاليدات الزئبـق (+1) نظراً لتطبيقاته العديدة في المختبر، الصناعة والطب.
– يحضر بعدة طرق نلخصها كما في التفاعلات التالية:
HgCl2 + Hg → Hg2Cl2
HgCl2 + Hg + 2NaCl → Hg2Cl2 + Na2SO4
Hg2+ + 2Cl– → Hg2Cl2
– يتفاعل الكالوميل مع الأمونيا ليتشكل راسب أسود مؤلف من الزئبق الحر وكلوريد أميد الزئبق HgNH2Cl(+2) كما بالتفاعل التالي:
Hg2Cl2 + 2NH2 → HgNH2Cl + Hg + NH4Cl
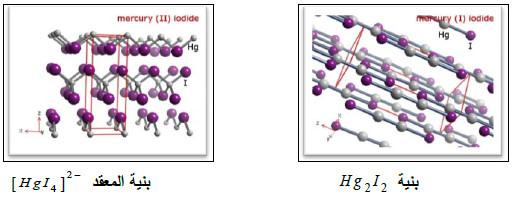
(جـ) يوديد الزئبق Hg2I2
– هو مركب أصفر اللون في الحالة النقية، يسود بفعل الضوء متحولاً إلى HgI2 و Hg
– بمعالجة يوديد الزئبق بيوديد قاعدي (مثل: KI) يتحول قسم منه إلى المعقد -2[HgI4] ويترسب الزئبق الحر.
(د) معقدات الزئبق
– لا تعرف الزئبق أحادي التكافؤ إلا بعض المعقدات وذلك بسبب عدم ميل الأيون –Hg22 إلى تشكيل روابط تساندية (روابط تناسقية) ولسهولة اختزاله وتأكسده الذاتيين، ولسهولة تشكيل معقدات ثابتة للأيون +Hg2 مع –CN و –I والأمينات RNH2.
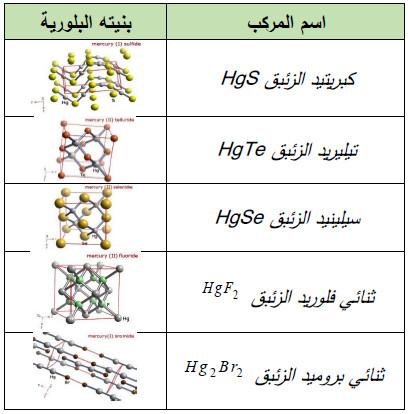
(هـ) مركبات أخري
– الجدول التالي يوضح مركبات مشهورة أخرى لهذا العنصر كما يلي:
(2) التفاعل مع الهواء
– يتفاعل الزئبق مع أكسجين الهواء في درجات الحرارة المرتفعة ليعطي أكسيد الزئبق كما بالتفاعل التالي:
أحمر Hg (s) + O2 (g) → 2HgO (s)
(3) التفاعل مع الهالوجينات
– يتفاعل الزئبق مع كل الهالوجينات ليعطي هاليدات الزئبق كما بالتفاعلات التالية:
أبيض Hg (1) + F2 (g) → HgF2 (s)
أبيض Hg (1) + Cl2 (g) → HgCl2 (s)
– بنفس الطريقة يتفاعل الزئبق مع البرزم واليود كما بالتفاعلات الآتية:
أبيض Hg (1) + Br2 (l) → HgBr2 (s)
أحمر Hg (1) + I2 (s) → HgI2 (s)
(4) التفاعل مع الأحماض
– الزئبق لا يتفاعل مع الأحماض غير المؤكسدة، لكن يمكن أن يتفاعل مع حمض الكبريتيك المركز H2SO4 كما بإمكانه أن ينحل في HNO3 ليعطي نتريت الزئبق Hg2(NO3)2
استخدامات الزئبق Uses of Mercury
يدخل الزئبق ومركباته في العديد من الاستخدامات، حيث يستعمل في المجالات الآتية كما يلي:
(1) مجال الصناعة: مثل إنتاج مواد كغاز الكلور وصناعات الورق.
(2) مجال الكهرباء: مثل إنتاج المصابيح والبطاريات.
(3) المجال العلمي والكيماوي: مثل صناعات الأصباغ، إنتاج المحاليل ومبيدات الفطريات.
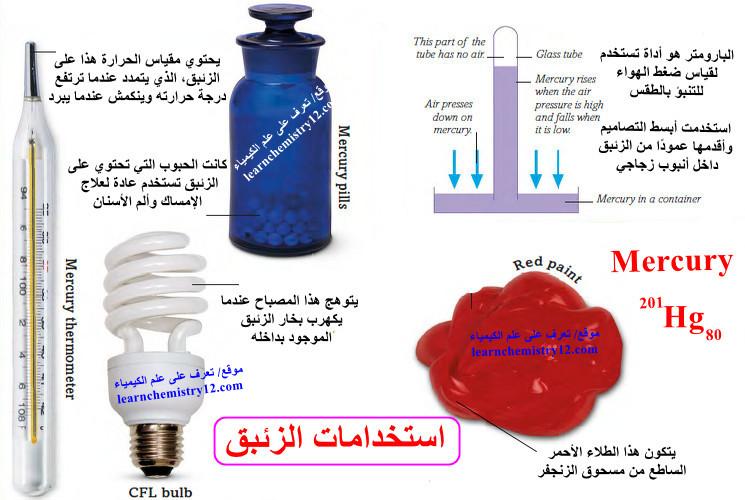
(4) المجال الصيدلاني: مثل صناعة بعض العقاقير حيث كانت الحبوب التي تحتوي على الزئبق تستخدم عادة لعلاج الإمساك وألم الأسنان. لقد توقف استخدامه تدريجيًا عندما تبين أنه سام.
(5) المجال الطبي مثل استعماله في صنع حشوات الأسنان.
(6) يُستخدم الزئبق في بعض البطاريات، وبعض أجهزة قياس الحرارة، وفي مصابيح الفلورسنت المدمجة منخفضة الطاقة (CFL).
(7) كما تستخدم مركباته في تحضير الدهانات القوية ذات اللون الأحمر حتى أوائل القرن الثامن عشر.
(8) البارومتر هو أداة تستخدم لقياس ضغط الهواء للتنبؤ بالطقس. استخدمت أبسط التصاميم وأقدمها عمودًا من الزئبق داخل أنبوب زجاجي
(9) كذلك تُستخدم المرآة الكبيرة ومنخفضة التكلفة المصنوعة من مجموعة من الزئبق النقي في التلسكوب الفلكي.
– وقد ثبت اليوم عدم صحة الكثير من طرق استخداماته التقليدية وخطرها على الصحة.
تأثير الزئبق على الإنسان
– حتى الآن، لم يكتشف العلماء أن جسم الإنسان يحتاج لأي كمية من الزئبأق، بل بالعكس فهو شديد السمية ويتراكم في الدماغ حيث قد يتسبب في تدمير الجهاز العصبي.
– لذلك ينصح بتجنب ملامسة الزئبـق وحمله في اليد.
– هذا المعدن سام للغاية ويمكن أن يلحق الضرر بالأعضاء والأعصاب إذا تم استنشاقه أو ابتلاعه.
– كذلك ينصح بتجنب الاقتراب منه لتفادي استنشاق بخار الزئبق حيث أنه سريع التبخر.
– يقدر نصف العمر للزئبق في الدماغ بـ 230 يوماً وفي بقية الجسم 70 يوماً.
تأثير الزئبق على البيئة
– يشكل الزئبق أكبر ملوث لمياه المحيطات البحار الأنهار والبحيرات، والغريب في الأمر أن جزءًا كبيراً من هذا التلوث يأتي من الطبيعة نفسها وليس من المخلفات الصناعية.
– سنوياً ينطرح ما يقدره بعض المختصين بين 4000 و10000 طن من الزئبـق في البحار، %40 منها تقريباً من أسباب طبيعية مثل البراكين والنحت الطبيعي للصخور المتضمنة للزئبـق، والباقي من المخلفات الصناعية وخصوصاً حرق القمامة واستهلاك الفحم الحجري وصنع الإسمنت.
– مثله مثل الماء يتبخر الزئبق وينتشر مع الهواء وقد يسافر إلى أماكن بعيدة جدا لكنه في النهاية يترسب في البحار والبحيرات، وهنا تكمن المشكلة ذلك لأن الأسماك تمتص هذا المعدن ليتخزن في جسمها. لذلك يجب الحذر عند استهلاك الأسماك ومعرفة من أين تم اصطيادها لتفادي الأماكن الملوثة، ربما مثل البحر الأبيض المتوسط والخليج العربي.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017