الكيمياء العامةعناصر الجدول الدورى
معلومات هامة جداً عن عنصر السيليكون Silicon

أولاً/ ما هو عنصر السيليكون؟ What is Silicon element
– التوزيع الإلكتروني له : 1S2 , 2S2 2P6 , 3S2 3P2
– هو عنصر شبه معدن (شبة فلز) رمادي اللون، قاس وقابل للكسر ويتمتع بدرجة انصهار عالية.

– يشبه في تركيبه البلّوري الماس حيث ترتبط كل ذرة سيليكون بأربع ذرات أ خرى تقع على رؤوس هرم رباعي الوجوه بواسطة أربع روابط مشتركة، وهكذا فإنه يعطي تجمعات كبيرة خاملة كيميائية.
– يعرف له ثلاثة نظائر طبيعية ثابتة وهي: Si30 , Si29 , Si28 كما يعرف له النظائر المشعة التالية: Si32 , Si31 , Si27 , Si26 , Si25
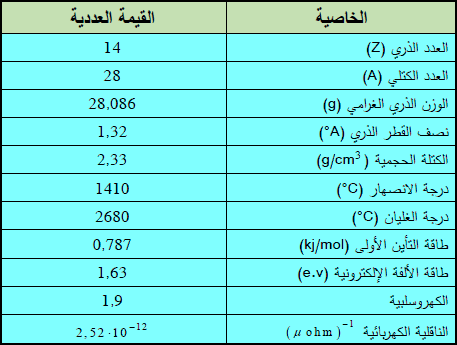
– الجدول التالي يوضح بعض الخواص العامة لهذا العنصر:
ثانياً/ اكتشاف السيليكون ووجوده في الطبيعة Discovery of Silicon
– لا يعرف تماما من اكتشفه أو أكتشف مركباته وذلك لأن السيليكا (بشكل صوان) استخدمه الإنسان الحجري.
– كلمة سيليكا تعني في اللاتينية (Silex) أي الصوّان.
– استطاع برزيليوس Berzéliusفي السويد عام 1823م من استحضار السيليكون العديم الشكل (مسحوق بني) من التفاعل:
– يأتي في المرتبة الثانية بعد الأكسجين من حيث سعة انتشار في القشرة الأرضية، فهو يؤلف 28 % من وزنها.
– لا يوجد بشكل حر في الطبيعة ولكنه على شكل مركبات عديدة أهمها أكسيد السيليكون أو ما يدعى بالسيليكا، وهو المركب المؤلف للرمال وأحجار الصوان والكوارتز، وكذلك يوجد على شكل سيليكات معقدة للألمنيوم والماغنسيوم والمعادن الأخرى وجميعها يدخل في تركيب القسم الأعظم للقشرة الأرضية.
– أهم خامات السيليكون:
الفلسبار Felspar: K2O.Al2O3.6SiO2
الكاولينيت:Kaolinite Al2O3.2SiO2.2H2O
ثالثاً/ تحضير عنصر السيليكون Preparation of Silicon
– يحضر السيليكون المستخدم في الخلائط بإختزال الكوارتز بالكربون أو كربيد الكالسيوم بوجود الحديد في فرن كهربائي:
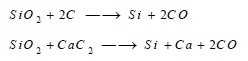
– يحضر السيليكون العديم الشكل من إرجاع SiF4 بالبوتاسيوم أو من إرجاع الكوارتز بالماغنسيوم:
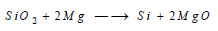
رابعاً/ الخواص الكيميائية لعنصر السيليكون Chemical properties of Silicon
(1) التفاعل مع الهواء Reaction between Silicon and air
لا يتأثر بالهواء عند الدرجة العادية وتكون الأكسدة حتى في الدرجة 950 °م بطيئة جدا وذلك لتشكل طبقة رقيقة وواقية من السيليكا شبيهة الزجاج.
(2)التفاعل مع الماء Reaction between Silicon and water
لا يتأثرمسحوقه بالماء النقي، ولكن في الدرجة 600 °م يحرر الهيدروجين:
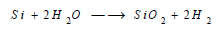
(3) التفاعل مع الهيدروجين Reaction between Silicon and Hydrogen
تكون هيدريد السيليكون عند تفاعله مع الهيدروجين:
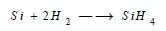
(4) التفاعل مع القواعد Reaction between Silicon and Bases
يتفاعل مع القواعد القوية ويشكل أملاح السيليكات:
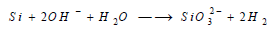
(5) التفاعل مع الهالوجينات Reaction between Silicon and Halogens
يتفاعل مع الهالوجينات ومشتقاتها الفعالة، ففي الدرجة العادية يتفاعل مع F2 ، وفي الدرجة 300 °م مع الكلور وفي 500 °م مع البروم:
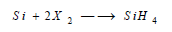
(6) تفاعل السيليكون مع الأحماض Reaction between Silicon and Acids
لا يتأثر السيليكون البلوري بجميع الأحماض حتى HF ، إلا أن المسحوق والعديم الشكل تتفاعل مع HF , HNO3 فقط، ويكون الناتج الرئيسي H2SiF6.
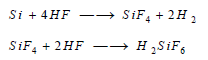
(7) تفاعل السيليكون مع النيتروجين Reaction between Silicon and Nitrogen
يتفاعل مع الآزوت في درجة حرارة تفوق 1400 °م ليشكل SiN و Si3N4 ويتفاعل العديم الشكل أيضا مع النشادر عند الدرجة الحمراء:
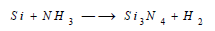
(8) تفاعل السيليكون مع الكبريت Reaction between Silicon and Sulfur
– يتفاعل كذلك مع بخار الكبريت ليشكل SiS2
– ومع بخار الفوسفور عند الدرجة 1000 م o، ومع بعض المعادن ليشكل السيليسيدات منها ما يخضع للتناسب الكيميائي مثل Ca2Si , Mg2Si ومنها ما لا يخضع للتناسب الكيميائي مثل M2Si , MSi ( حيث M: معدن أساسي أو أساسي ترابي عدا (Ca , Mg , Be
خامساً/ استخدامات عنصر السيليكون Uses of Silicon
– تعتبر السيليكا والسيليكات الطبيعية من المواد الأولية والرئيسية المستخدمة لصناعة مواد البناء والمواد الحرارية والزجاج.
– لا تستخدم إلا كميات صغيرة من السيليكا لتحضير السيليكون المستخدم في العمليات التعدينية بشكل خلائط الفيروسيليكون، ولتحضير بعض المركبات مثل السيليكونات أو بعض السيليكات. وكذلك لتحضير السيليكون النقي جيداً.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.