البزموث Bismuth – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر البزموث Bismuth؟
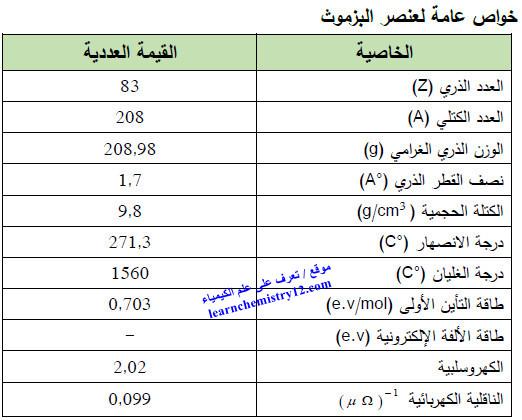
– البزموث أو البزموت Bismuth هو عنصر من عناصر الجدول الدوري: العدد الذري = 83 ، العدد الكتلي = 209
– الرمز الكيميائي لعنصر البزموث يرمز له بالرمز: 209Bi83
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d10 6p3]
– البزموث فلز لامع ذو لون أبيض محمر.
– ناقل للكهرباء والحرارة.
– هش يمكن تحويله بسهولة إلى مسحوق.
– يكون في الحالة العادية على شكل جزيئات Bi2
– تزداد مقاومته الكهربائية تحت الحقل المغناطيسي وتنخفض مرتين بعد انصهاره، ولكنها ترتفع فجأة أثناء تبريده.
– بفضل بنيته البلورية الخاصة فهو يتمدد أثناء تجمده بعكس الفلزات الأخرى وينجم عن هذا ظاهرة أخرى وهي تحوله بسهولة إلى حالة سائلة كلما ازداد الضغط.
– على عكس معظم العناصر، فإن الحالة السائلة للبزموت أثقل من حالته الصلبة.
– الجدول التالي يوضح الخواص العامة لعنصر البزموت كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Bismuth
– اكتشف من قبل الفرنسي (كلود جيو فراي) اشتق اسمه من الألمانية Weisse masse، بمعنى كتلة بيضاء وهذا راجع إلى لونه.
– البزموث عنصر مشع لكن ذراته مستقرة نسبياً وتستمر لملايين السنين.
– لقد عرف الناس عن البزموث لعدة قرون حيث أضافه الإنكا في أمريكا الجنوبية إلى الأسلحة المصنوعة من سبائك البرونز لتقويتها، بينما استخدم المصريون القدماء معدن البزموث لجعل مستحضرات التجميل الخاصة بهم براقة.
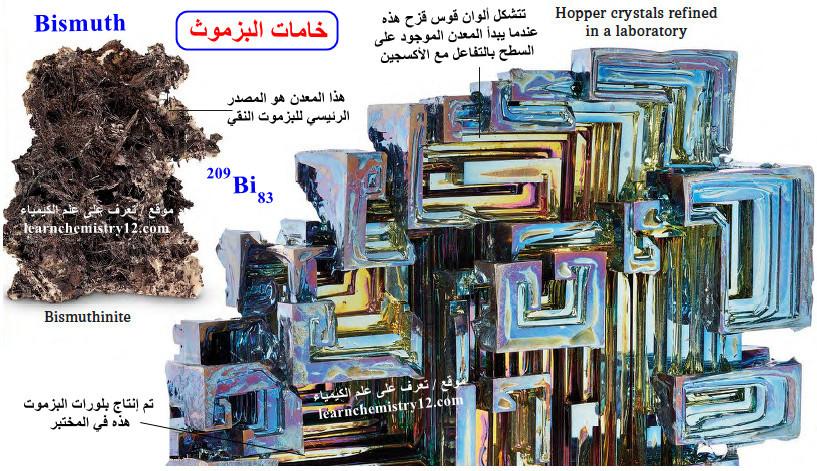
– يشكل البزموت النقي أكسيدًا في الهواء يُرى على شكل بلورات ملونة تسمى بلورات القادوس Hopper crystals حيث تتشكل ألوان قوس قزح عندما يبدأ المعدن الموجود على السطح بالتفاعل مع الأكسجين.
– في القشرة الأرضية، تبلغ كمية البزموت ضعف كمية الذهب.
– خام Bismuthinite هو المصدر الرئيسي للبزموت النقي.
تحضير البزموث Preparation of Bismuth
– يسخن الخام المحتوي على البزموث بالهواء في درجات حرارة منخفضة، ثم يختزل بالكربون، أما خامات الكبريتيد تختزل بالحديد.
مركبات البزموث Bismuth Compounds
(1) أكاسيد البزموث
(أ) أحادي أكسيد البزموث BiO
– يتكون بتسخين أوكسالات قاعدية كما بالتفاعل التالي:
– يتحول هذا الأكسيد إلى ثلاثي أكسيد ثنائي البزموت عند تسخينه في الهواء كما بالتفاعل:
4BiO + O2 → 2Bi2O3
– يوجد ثالث أكسيد ثنائي البزموت طبيعياً على هيئة مسحوق أصفر اللون، يتكون أيضاً عند تسخين نترات البزموت أو كربونات البزموت عند حرارة عالية، كما بالتفاعل التالي:
Bi2(CO3)3 → Bi2O3 + 3CO2
هذا الأخير في الأحماض وليست له أي خصائص حمضية.
(ب) خماسي أكسيد ثنائي البزموث Bi2O5
– يحضر بأكسدة Bi2O3 بمؤكسد قوي مثل KMnO4 أو NaOCl في وسط قاعدي أو بتفاعل أملاح البزموثات مع HNO3
– يشكل Bi2O3 مع هيدروكسيدات المعادن القاعدية المركزة أملاح بزموث المعادن المقابلة مثل NaBiO3 أو Na3BiO4
(2) هاليدات البزموث
(أ) أحادي كلوريد البزموث BiCl
– يتكون عند اتحاد البزموث مباشرة مع غاز الكلور لكنه سريعاً ما ينحل إلى البزموت وثالث كلوريد البزموت كما بالتفاعل التالي:
2Bi + Cl2 → 2BiCl2
(ب) ثالث كلوريد البزموت BiCl3
– يحضر بالتفاعل المباشر بين غاز الكلور والبزموث.
– يكون على هيئة سائل أصفر تتسامى منه عند تسخينه بعض البلورات التي تنصهر عند 223o م.
– يتحول ثالث كلوريد البزموت عند معاملته بالماء إلى أكسي كلوريد البزموث كما بالتفاعل التالي:
BiCl3 + H2O → BiOCl + 2HCl
– كما يتفاعل ثالث كلوريد البزموت مع غاز الكلور مكوناً رابع كلوريد البزموت.
2BiCl3 + Cl2 →2BiCl4
(3) مركباته مع الكبريت
(أ) أحادي كبريتيد البزموث BiS
– يتكون عند إمرار غاز كبريتيد الهيدروجين في محلول قلوي من ترترات البزموث والبوتاسيوم، وذلك في وجود كلوريد القصديروز.
(ب) ثلاثي كبريتيد ثنائي البزموت Bi2S3
– يحضر على شكل بلورات رمادية وذلك بصهر البزموث مع الكبريت.
– كما يمكن تحضيره على شكل راسب بني مسود وذلك بتمرير غاز كبريتيد الهيدروجين في محلول يحتوي على الأيونات 3+B كما بالتفاعل التالي:
+2Bi3+ + 3H2S → Bi2S3 + 6H3O
– لا يذوب Bi2S3 بعكس كبريتيد الزرنيخ وكبريتيد الأنتيمون في المحاليل المحتوية على الأيونات S-2.
(4) ثلاثي هيدريد البزموت BiH3
– يحضر بتأثير حمض HCl على أشباه من البزموث والمغنيزيوم كما في التفاعل التالي:
Mg3Bi2 + HCl → 3MgCl2 + 2BiH3
(5) هيدروكسيد البزموت Bi(OH)3
– يحضر بترسيبه على شكل راسب أبيض وذلك بإضافة محلول هيدروكسيد معدن أساسي على محاليل أملاح البزموث، ويتحول بالتسخين في درجة حرارة تقدر بـ 100مo.
(6) مركبات أخرى
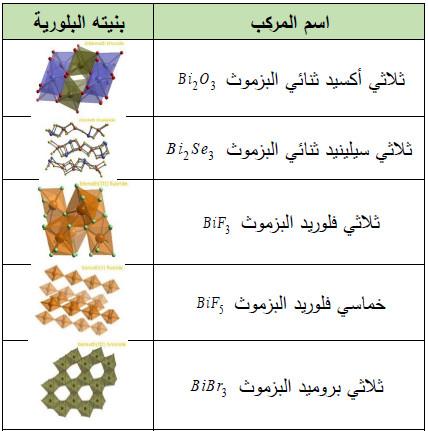
– الجدول التالي يوضح مركبات البزموث الأخرى الأكثر شهرة كما يلي:
الخواص الكيميائية لعنصر البزموث Chemical properties of Bismuth
(1) التفاعل مع الهواء
– عند التسخين يتفاعل البزموث مع الهواء لتشكيل ثلاثي أكسيد البزموث، ويصحب هذا التفاعل شعلة بيضاء:
4Bi (s) + 3O2 (g) → 2Bi2O3 (s)
(2) التفاعل مع الماء
– يمكن للبزموث كذلك أن يتفاعل مع الماء لتشكيل ثلاثي أكسيد البزموث كما بالتفاعل التالي:
2Bi (s) + 3H2O (g) → Bi2O3 (s) + 3H2 (g)
(3) التفاعل مع الهالوجينات
– البزموث يتفاعل مع الفلور لتشكيل خماسي فلوريد البزموث كما بالتفاعل التالي:
2Bi (s) + 5F2 (g) → 2BiF5 (s)
– كما يمكن له أن يتفاعل مع كل الهالوجينات لتشكيل ثلاثي هاليد البزموث كما بالتفاعلات التالية:
2Bi (s) + 3F2 (g) → 2BiF3 (s)
2Bi (s) + 3Cl2 (g) → 2BiCl3 (s)
ويتفاعل بنفس الطريقة مع البروم واليود كما يلي:
2Bi (s) + 3Br2 (g) → 2BiBr3 (s)
2Bi (s) + 3I2 (g) → 2BiI3 (s)
(4) التفاعل مع الأحماض
– يتفاعل البزموث مع حمض الكبريتيك المركز أو حمض النتريك المركز وفي وجود حمض الهيدروكلوريك لتشكيل محاليل تحتوي على أيون البزموت كما بالتفاعل التالي:
4Bi (s) + 3O2 (g) + 12HCl (aq) → 4BiCl3 (aq) + 6H2O (l)
استخدامات البزموث Uses of Bismuth
(1) يستعمل في مجال الطب حيث دخل بشكل كبير في العديد من الأدوية، المراهم والمساحيق التي تستعمل كمواد مطهرة أثناء معالجة الأمراض الجلدية، أمراض جهاز الهضم والتئام الحروق والجروح.
(2) يستعمل أيضاً في مجال الصناعة، فسبيكة (وود) المعروفة أنها مزيج من البزموث، الرصاص، القصدير والكادميوم، تساعد على إحكام الزجاج بالمعدن، ويصنع من هذه السبيكة المغناطيس وذلك بإضافة المنغنيز لها.
(3) إن لمركبات البزموت مع التوليوم فائدة في صنع المولدات الكهربائية لتحويل الطاقة الحرارية إلى طاقة كهربائية، كما تضاف مركباته إلى الزجاج عندما يراد رفع قرينة انكساره.
(4) أما أملاح البزموث فهي تستعمل في صنع الدهانات الخاصة بإشارات المرور حيث تجعلها تلمع عندما يسقط عليها الضوء الصادر عن السيارات.
(5) علاوة على ذلك يستعمل البزموث في مجال الزينة منذ القدم في صناعة أصبغة الشعر ومواد التجميل فمثلا أملاح البزموت يصنع منها أحمر الشفاه.
(6) كما تستخدم أصباغ البزموت الصفراء في الدهانات ومستحضرات التجميل، في حين أن العديد من مركبات البزموت تستخدم أيضا في الأدوية.
(7) سبيكة من البزموت والقصدير هي أحد مكونات رشاشات الحريق.
تأثيره في جسم الإنسان
– فلز البزموث وأملاحه تسبب ضمور الكلى على الرغم من أن درجة الضمور هذه عادة لا تكون حادة، لكن الجرعات الكبيرة منه مميتة.
– من آثاره السامة كما يلي:
- إحساس بعدم الارتياح.
- نزول زلال أو مواد بروتينية في البول.
- الإسهال.
- اضطرابات الجلد وفي بعض الأحيان الالتهاب الحاد للطبقة الخارجية للجلد.
– لا يعتبر البزموث من العوامل المسرطنة.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان. أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson. – consultant Jack Challoner – Great Britain 2017