الكيمياء العامة
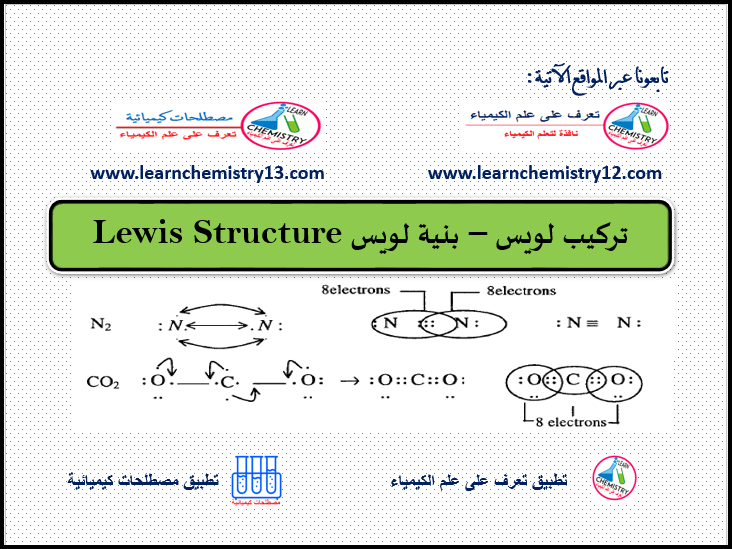
تركيب لويس – بنية لويس Lewis Structure
من
هو لويس؟
جيلبرت
نيوتن لويس Gilbert Newton
Lewis هو عالم
كيمياء فيزيائية أمريكي الجنسية ولد في 23/10/1875 ، بحث وأسس لنظريات الربط الحديثة. توفي سنة
1946 وهو يعمل في إحدى التجارب المخبرية. قام لويس بوضع طريقة بسيطة لتمثيل الكترونات
التكافؤ وهي الإلكترونات التي عندها بعض من حرية الحركة. سمي ذلك تركيب لويس. تطبق
طريقة لويس في التعبير عن الإلكترونات بالنقط.
نيوتن لويس Gilbert Newton
Lewis هو عالم
كيمياء فيزيائية أمريكي الجنسية ولد في 23/10/1875 ، بحث وأسس لنظريات الربط الحديثة. توفي سنة
1946 وهو يعمل في إحدى التجارب المخبرية. قام لويس بوضع طريقة بسيطة لتمثيل الكترونات
التكافؤ وهي الإلكترونات التي عندها بعض من حرية الحركة. سمي ذلك تركيب لويس. تطبق
طريقة لويس في التعبير عن الإلكترونات بالنقط.
أشكال
لويس
هي طريقة لرسم شكل الجزيء، بحيث تبين ترتيب إلكترونات
التكافؤ وعدد الروابط في ذرات الجزيء. ويرمز للإلكترون الحر بنقطة والرابطة الأحادية
بنقطتين أو خط والرابطة الثنائية بأربعة نقاط أو خطين والثلاثية بستة نقاط أو ثلاث خطوط. ويمكن رسم شكل
لويس لأي جزي يتمتع برابطة تساهمية أو للمركبات ذات الروابط التناسقية
التكافؤ وعدد الروابط في ذرات الجزيء. ويرمز للإلكترون الحر بنقطة والرابطة الأحادية
بنقطتين أو خط والرابطة الثنائية بأربعة نقاط أو خطين والثلاثية بستة نقاط أو ثلاث خطوط. ويمكن رسم شكل
لويس لأي جزي يتمتع برابطة تساهمية أو للمركبات ذات الروابط التناسقية
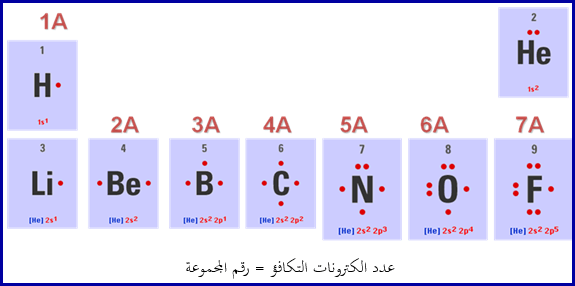
رموز
لويس للعناصر:
يحاط
رمز العنصر بعدد من النقاط يساوي الكترونات التكافؤ وتساوي رقم المجموعة التي يوجد
بها العنصر
رمز العنصر بعدد من النقاط يساوي الكترونات التكافؤ وتساوي رقم المجموعة التي يوجد
بها العنصر
كيفية
رسم تركيب لويس
1- حدد
الذرة المركزية (الذرة ذات السالبية الكهربية الاقل والتكافؤ الأعلى).
الذرة المركزية (الذرة ذات السالبية الكهربية الاقل والتكافؤ الأعلى).
2- احسب
عدد الكترونات التكافؤ لكل عنصر.
عدد الكترونات التكافؤ لكل عنصر.
3- احسب
العدد الكلي لإلكترونات التكافؤ في الجزيء.
العدد الكلي لإلكترونات التكافؤ في الجزيء.
4- اربط
الذرة المركزية بالذرات الأخرى بروابط تساهمية (كل نقطتين او خط مستقيم قصير يمثل رابطة
تساهمية وهي عبارة عن زوج من الالكترونات وتسمي الالكترونات الرابطة).
الذرة المركزية بالذرات الأخرى بروابط تساهمية (كل نقطتين او خط مستقيم قصير يمثل رابطة
تساهمية وهي عبارة عن زوج من الالكترونات وتسمي الالكترونات الرابطة).
5- اطرح
عدد الالكترونات الرابطة من العدد الكلي لإلكترونات التكافؤ ووزع الباقي على الذرات
الخارجية بحيث تحصل كل ذرة على ثمانية الكترونات ما عدا الهيدروجين يحصل على الكترونين
فقط.
عدد الالكترونات الرابطة من العدد الكلي لإلكترونات التكافؤ ووزع الباقي على الذرات
الخارجية بحيث تحصل كل ذرة على ثمانية الكترونات ما عدا الهيدروجين يحصل على الكترونين
فقط.
6- الباقي
من الكترونات التكافؤ يضاف الي الذرة المركزية على هيئة الكترونات غير رابطة.
من الكترونات التكافؤ يضاف الي الذرة المركزية على هيئة الكترونات غير رابطة.
7- إذا
كان عدد الالكترونات على الذرة المركزية اقل من ثمانية تستخدم الازواج الالكترونية
غير الرابطة في عمل روابط ثنائية بين الذرة المركزية والذرات الخارجية.
كان عدد الالكترونات على الذرة المركزية اقل من ثمانية تستخدم الازواج الالكترونية
غير الرابطة في عمل روابط ثنائية بين الذرة المركزية والذرات الخارجية.
أو
يمكنك تتبع المخطط التالي لرسم تركيب لويس:
يمكنك تتبع المخطط التالي لرسم تركيب لويس:

ملاحظات هامة عند رسم تركيب لويس
1- الذرة
المركزية هي التي تكتب أولاً
المركزية هي التي تكتب أولاً
2-
إذا كان الجزيء أيوناً سالباً (Anion) نضيف إلى عدد إلكترونات التكافؤ عدداً يماثل
الشحنة التي يحملها الأيون السالب.
إذا كان الجزيء أيوناً سالباً (Anion) نضيف إلى عدد إلكترونات التكافؤ عدداً يماثل
الشحنة التي يحملها الأيون السالب.
3- إذا كان الجزيء أيوناً موجباً (Cation) نطرح من عدد إلكترونات التكافؤ عدداً يماثل الشحنة التي يحملها الأيون
الموجب.
الموجب.
4-
يبدأ بتوريع إلكترونات التكافؤ (التي تشكل الروابط) على ذرات الجزيء بحيث تأخذ ذرة
الهيدروجين الكترونين وأي ذرة أخرى سيكون نصيبها (8) إلكترونات.
يبدأ بتوريع إلكترونات التكافؤ (التي تشكل الروابط) على ذرات الجزيء بحيث تأخذ ذرة
الهيدروجين الكترونين وأي ذرة أخرى سيكون نصيبها (8) إلكترونات.
أمثلة
لرسم تركيب لويس
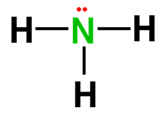
مثال1:
ارسم شكل لويس للأمونيا NH3
ارسم شكل لويس للأمونيا NH3
الحل:
1- الذرة
المركزية هي النيتروجين
المركزية هي النيتروجين
2- عدد
الكترونات التكافؤ H =
1 ، N = 5
الكترونات التكافؤ H =
1 ، N = 5
3- العدد
الكلي لإلكترونات التكافؤ = (3×1) + 5 = 8
الكلي لإلكترونات التكافؤ = (3×1) + 5 = 8
4- وصل
الذرة المركزية بالذرات الأخرى بروابط تساهمية أحادية
الذرة المركزية بالذرات الأخرى بروابط تساهمية أحادية
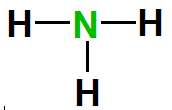
عدد الالكترونات
الرابطة = 6
الرابطة = 6
الفرق
= 8-6 = 2 يوضع على هيئة زوج غير رابط على الذرة المركزية
= 8-6 = 2 يوضع على هيئة زوج غير رابط على الذرة المركزية
مثال
2: ارسم تركيب لويس لثاني اكسيد الكربون CO2
2: ارسم تركيب لويس لثاني اكسيد الكربون CO2
الحل:
1- الذرة
المركزية الكربون
المركزية الكربون
2- عدد
الكترونات التكافؤ = (2×6) +4 = 16
الكترونات التكافؤ = (2×6) +4 = 16
3- كون
الروابط التساهمية
الروابط التساهمية
4- الفرق
بين الإلكترونات الرابطة والعدد الكلي لإلكترونات التكافؤ = 16-4=12 توزع على الذرات
الخارجية (الأكسجين) لتحصل كل منها على ثمانية الكترونات.
بين الإلكترونات الرابطة والعدد الكلي لإلكترونات التكافؤ = 16-4=12 توزع على الذرات
الخارجية (الأكسجين) لتحصل كل منها على ثمانية الكترونات.
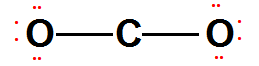
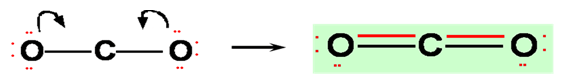
5- لكي
تحصل الكربون على ثمانية الكترونات كون روابط ثنائية بينها وبين ذرات الاكسجين
تحصل الكربون على ثمانية الكترونات كون روابط ثنائية بينها وبين ذرات الاكسجين
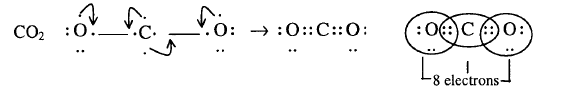
مثال
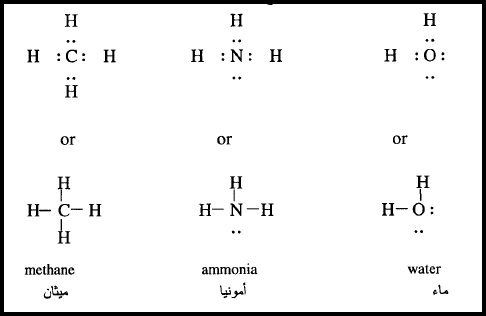
3: ارسم تركيب لويس للماء والنشادر والميثان ؟
3: ارسم تركيب لويس للماء والنشادر والميثان ؟
الحل:
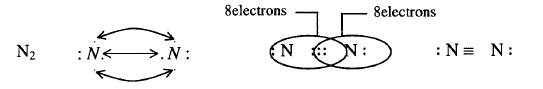
مثال 4: ارسم تركيب لويس لغاز
النيتروجين؟
النيتروجين؟
الحل:
مثال 5: ارسم تركيب لويس للأرسين AsH3
الحل:
عدد إلكترونات التكافؤ = (5×1) للزرنيخ +
(3×1) للهيدروجين =
8 الكترونات
(3×1) للهيدروجين =
8 الكترونات
ثلاث روابط بين الزرنيخ والهيدوجين والكترونين (زوج غير رابط) على ذرة الزرنيخ
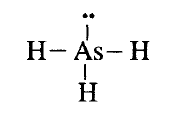
المراجع
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.





لكنني اريد تمثل لويس على جزيء الاستيلين
لا يوجد