الكيمياء التحليلية تهتم بدراسة تركيب المواد وتحديد مكوناتها. تشمل التحليل الكيفي والكمي، وتُستخدم في المختبرات والصناعات لتحديد نقاء المواد واكتشاف العناصر والمركبات بدقة.
الكيمياء التحليلية
-
ملخص رائع لجميع قوانين pH الرقم الهيدروجيني
ما هو الرقم الهيدروجيني pH؟ يلعب تركيز أيون الهيدروجين فى المحاليل دورا رئيسياً فى الأنظمة البيولوجية ويعرف بأنه…
أكمل القراءة » -
كتاب معالجة مياة الشرب – هام جداً للكيميائيين
– استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام. نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة » -
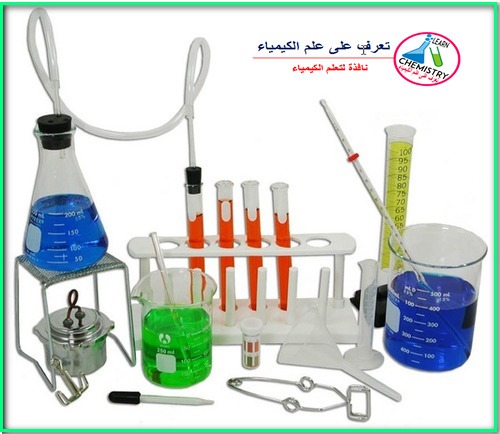
جميع أدوات معمل الكيمياء باللغتين العربية والانجليزية
– يجد بعض الكيميائيين المبتدئين صعوبة في حفظ أدوات معمل الكيمياء باللغة الإنجليزية ، لذا قمنا بالبحث عن انفوجرافات لجميع…
أكمل القراءة » -
المولارية Molarity + مسائل محلولة
تعريف المولارية Molarity – المولارية هي أحدى طرق التعبير عن التركيز ويرمز لها بالرمز M وبالإنجليزية Molarity – وتعرف المولاريــة بعدد…
أكمل القراءة » -
طرق التعبير عن تركيز المحاليل Concentration of Solutions
في هذا الموضوع سيتم مناقشة كل الطرق المشهورة المعبرة عن تركيز المحاليل. المحلول Solution – المحلول عبارة عن خليط متجانس من…
أكمل القراءة »