الكيمياء التحليلية تهتم بدراسة تركيب المواد وتحديد مكوناتها. تشمل التحليل الكيفي والكمي، وتُستخدم في المختبرات والصناعات لتحديد نقاء المواد واكتشاف العناصر والمركبات بدقة.
الكيمياء التحليلية
-
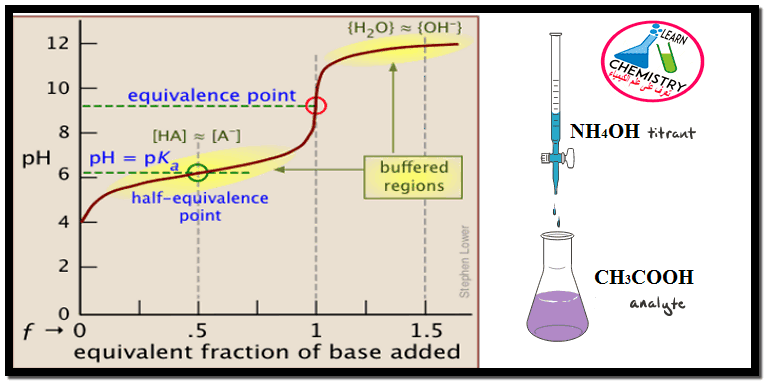
منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
– في هذا الموضوع سيتم استنتاج ورسم منحنى معايرة حمض ضعيف مع قاعدة ضعيفة Titration Curve of a weak base…
أكمل القراءة » -
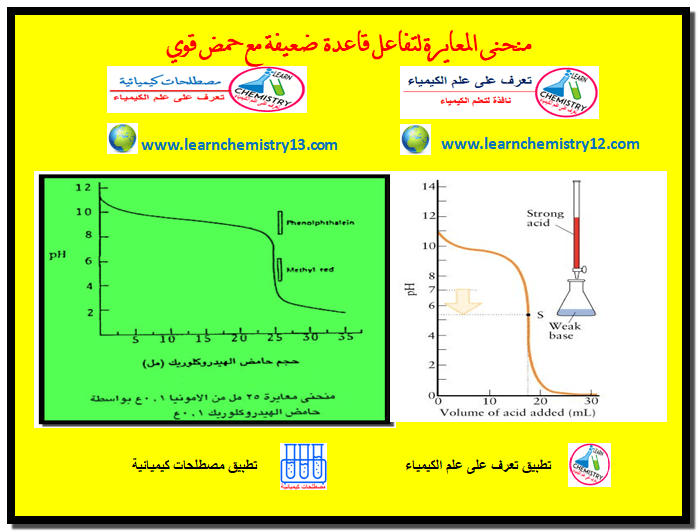
منحنى معايرة قاعدة ضعيفة مع حمض قوي
– في هذا الموضوع سيتم استنتاج ورسم منحنى معايرة قاعدة ضعيفة مع حمض قوي Titration Curve of a weak base…
أكمل القراءة » -
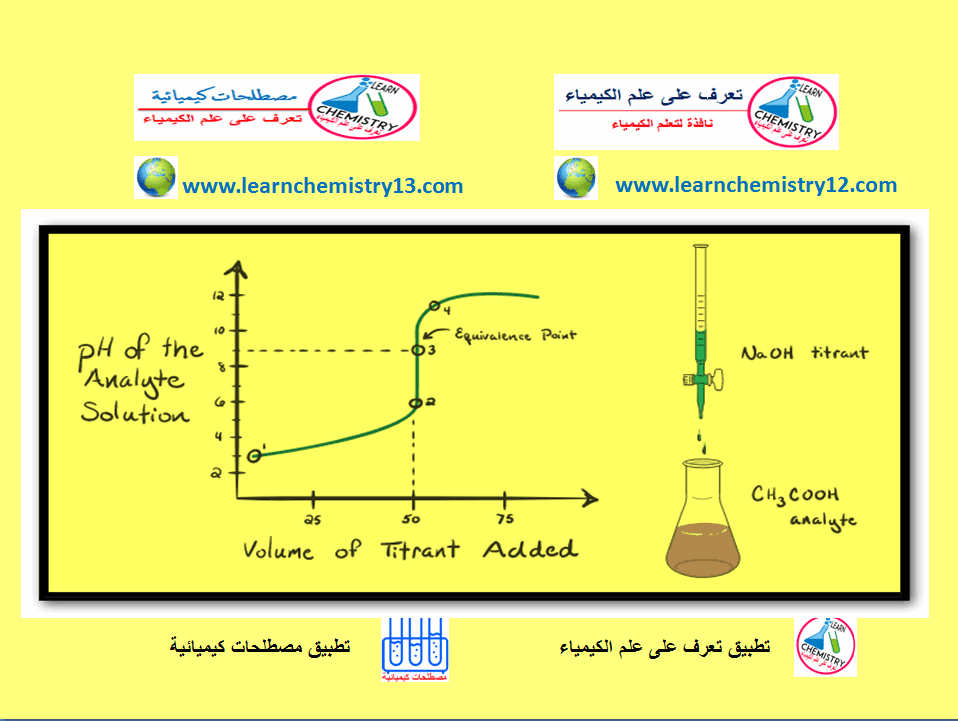
رسم منحنى المعايرة لتفاعل حمض ضعيف مع قاعدة قوية
في هذا الموضوع سيتم مناقشة كيفية رسم منحنى المعايرة لتفاعل حمض ضعيف مع قاعدة قوية Titration Curve of a weak acid…
أكمل القراءة » -
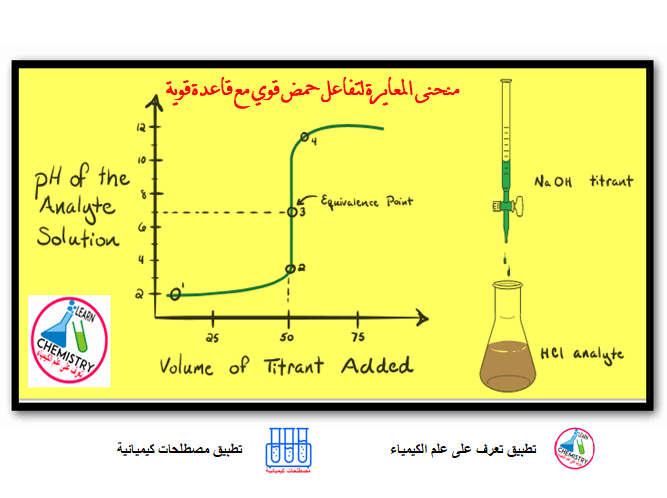
منحنى معايرة حمض قوي مع قاعدة قوية
في هذا الموضوع سيتم مناقشة منحنى معايرة حمض قوي مع قاعدة قوية Titration Curve of a strong acid with a…
أكمل القراءة » -
حساب الرقم الهيدروجيني pH للمحاليل المنظمة
في هذا الموضوع سيتم مناقشة وحساب الرقم الهيدروجيني pH للمحاليل المنظمة pH laws for buffer solution بالتفصيل. تعريف المحاليل المنظمة…
أكمل القراءة » -
تأين الأملاح Disassociation of salts واشتقاق قوانين pH
– وفي هذا الموضوع سيتم مناقشة عن الاتزان في الأملاح (تأين الأملاح) وكيفية اشتقاق قوانين pH للأملاح الناتجة من حمض…
أكمل القراءة » -
تأين الأحماض والقواعد واشتقاق قوانين pH
– في هذا الموضوع سيتم مناقشة الأتزان في الأحماض والقواعد وتأين الأحماض والقواعد Acid – base equilibrium وكيفية اشتقاق قوانين…
أكمل القراءة » -
تفكك الماء – اشتقاق القانون pH + pOH =14
– في هذا الموضوع سيتم مناقشة تفكك الماء Dissociation of water – اشتقاق القانون pH + pOH =14 وكذلك أهم…
أكمل القراءة » -
نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل
نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل – تم وضع ثلاثة من نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات…
أكمل القراءة » -
المدى الهيدروجيني للدليل المستخدم فى تفاعلات المعايرة
تعريف المدى الهيدروجيني للدليل pH Indicators range – يعرف المدى الهيدروجيني للدليل بأنه المجال من الرقم الهيدروجيني الذي يتغير فيه…
أكمل القراءة » -
أنواع الأدلة فى معايرات التعادل Neutralization Indicators
– أن أنواع الأدلة في معايرات التعادل عديدة ولكن سنقوم بتقسيمها إلى أربع أنواع رئيسية. أنواع الأدلة فى معايرات التعادل…
أكمل القراءة » -
أنواع التفاعلات فى التحليل الحجمي
– في هذا الموضوع سيتم مناقشة أنواع التفاعلات في التحليل الحجمي وذكر نبذة مختصرة عن كل نوع من الأنواع الاخرى.…
أكمل القراءة » -
تجربة تعيين تركيز كربونات الصوديوم (Na2CO3) وهيدروكسيد الصوديوم(NaOH) في مخلوط منهما باستخدام (HCl)
فكرة تجربة تعيين تركيز كربونات الصوديوم وهيدروكسيد الصوديوم في مخلوط سنستخدم في هذه التجربة مخلوط من كربونات الصوديوم (Na2CO3)وهيدروكسيد الصوديوم (NaOH) مجهولي…
أكمل القراءة » -
قانون التخفيف للمحاليل Dilution Law + قوة المحلول (Strength (S
أولاً/ قانون التخفيف Dilution Law – قانون التخفيف أحد أهم القوانين الأكثر استخداماً في معمل الكيمياء التحليلية. – تتم عملية…
أكمل القراءة » -
العيارية Normality + مسائل محلولة
العيارية Normality العيارية ھي عدد الأوزان المكافئة الجرامیة (Eq) من المادة المذابة الموجودة في لتر من المحلول (Vsol) . يصاغ…
أكمل القراءة » -
المولالية Molality + مسائل محلولة
المولالية Molality ( التركيز الجزيئي الوزني ) المولالية ھي عدد مولات المادة المذابة في كیلوجرام من المذیب. والصيغة الرياضية…
أكمل القراءة » -
الكسر المولي Mole Fraction + مسائل محلولة
الكسر المولي Mole Fraction – الكسر المولي هو النسبة بين عدد مولات أحد مكونات المحلول (n) إلى مجموع مولات كل…
أكمل القراءة » -
النسبة المئوية الوزنية للمذاب Weight Percentage + مسائل محلولة
النسبة المئوية الوزنية للمذاب Weight Percentage النسبة المئوية الوزنية للمذاب هي كتلة المادة المذابة مقاسه بالجرامات الموجودة في مائة جرام…
أكمل القراءة » -
طرق حساب عدد المولات (المول) + مسائل محلولة
المول The Mole المول هو الكمية التي تحتوي على عدد أفوجادرو (NA) من الذرات أو الجزئيات أو الأيونات … الخ…
أكمل القراءة » -
طرق حساب الوزن المكافئ Equivalent weight
في البداية سوف نتطرق إلي بعض التعريفات الهامة المتعلقة بموضوع الوزن المكافئ، وفى نهاية الموضوع سوف نعرض القوانين الخاصة بالأوزان…
أكمل القراءة »