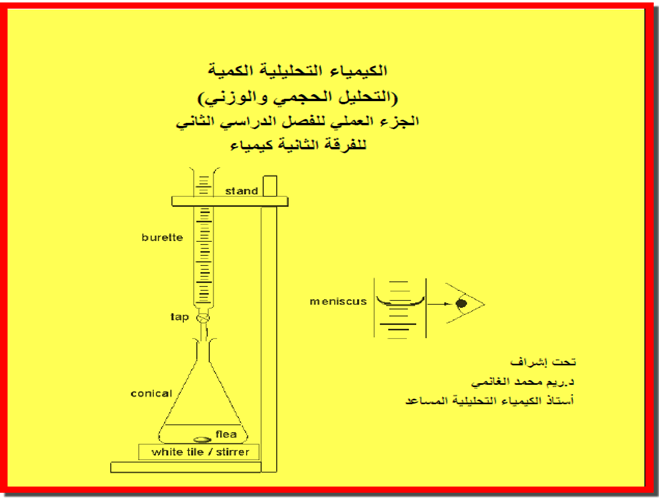
الكيمياء التحليلية تهتم بدراسة تركيب المواد وتحديد مكوناتها. تشمل التحليل الكيفي والكمي، وتُستخدم في المختبرات والصناعات لتحديد نقاء المواد واكتشاف العناصر والمركبات بدقة.
الكيمياء التحليلية
-
تجربة تقدير كمیة فوق أكسید الهیدروجین في عینة تجاریة
تجربة تقدير كمیة فوق أكسید الهیدروجین في عینة تجاریة اسم التجربة: تعیین كمیة فوق أكسید الهیدروجین (H2O2) في عینة تجاریة. الهدف…
أكمل القراءة » -
المعايرات اليودية – تجربة تقدير النحاس في أحد أملاحه الذائبة بواسطة اليود
الأساس النظري لتجربة تقدير النحاس بواسطة اليود (المعايرات اليودية) تنقسم عمليات الأكسدة بواسطة اليود ( المعايرات اليودية) إلى قسمين كما…
أكمل القراءة » -
تحليل عينة من خام الحديد بواسطة محلول قياسي من ثاني كرومات البوتاسيوم
تجربة تحليل عينة من خام الحديد بواسطة K2Cr2O7 – تحليل عينة من خام الحديد وتقدير النسبة المئوية للحديد في هذه…
أكمل القراءة » -
تجربة تقدير مولارية ثاني كرومات البوتاسيوم بواسطة محلول قياسي من كبريتات الحديدوز والأمونيوم
تجربة تقدير مولارية ثاني كرومات البوتاسيوم تقدير مولارية ثاني كرومات البوتاسيوم K2Cr2O7 وتركيزه كعامل مؤكسد قوي مع محلول قياسي من…
أكمل القراءة » -
تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك
الخلفية النظرية لتجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك – تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة محلول قياسي من…
أكمل القراءة » -
منحنيات معايرة الأكسدة والاختزال Redox Titration Curves
تعريف منحنيات معايرة الأكسدة والاختزال – یتم رسم منحنیات معايرة الأكسدة والاختزال Redox Titration Curves بالاستعانة بمعادلة نرنست. – یعبر…
أكمل القراءة » -
أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال
أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال – في هذا الموضوع سيتم مناقشة أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال…
أكمل القراءة » -
حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة
كيفية حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة – يمكن حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة Equivalent Weight of Oxidizing and…
أكمل القراءة » -
تحميل كتاب أسس الكيمياء التحليلية – د/ محمد مجدى واصل
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع هذا الكتاب الرائع…
أكمل القراءة » -
العوامل المختزلة الأكثر شيوعاً في معايرات الأكسدة والاختزال
العوامل المختزلة في معايرات الأكسدة والاختزال – فى هذا الموضوع سيتم مناقشة أهم العوامل المختزلة الأكثر شيوعاً في معايرات الأكسدة…
أكمل القراءة » -
العوامل المؤكسدة فى معايرات الأكسدة والأختزال
أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال – في هذا الموضوع سيتم مناقشة أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال…
أكمل القراءة » -
برمنجنات البوتاسيوم – الأكسدة بواسطة برمنجنات البوتاسيوم
– برمنجنات البوتاسيوم من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال وسيتم مناقشة الأكسدة بواسطة برمنجنات البوتاسيوم في هذا الموضوع…
أكمل القراءة » -
العوامل المؤكسدة Oxidizing agents
فى هذا الموضوع سوف نستعرض أهم العوامل المؤكسدة المستخدمة فى تفاعلات الأكسدة والأختزال Common oxidizing agents used in Redox reactions…
أكمل القراءة » -
تحميل كتاب الكيمياء التحليلية: المفاهيم الأساسية في التحليل التقليدي والآلي
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية في الروعة وهو…
أكمل القراءة » -
تحميل محاضرات كيمياء تحليلية pdf
– استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام ، نقدم لكم اليوم محاضرات كيمياء تحليلية Lectures…
أكمل القراءة » -
كتاب الطرائق الحديثة فى التحليل الكيميائي – بسكوك وكارنر مترجم
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع كتاب…
أكمل القراءة » -
تحميل كتاب أسس الكيمياء التحليلية – سكوج مترجم skooge
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا…
أكمل القراءة » -
الإسعافات الأولية في المعامل الكيميائية
– تحصل معظم الجروح للعاملين في المعامل الكيميائية نتيجة كسر أنابيب الإختبار أو موازين الحرارة (الترمومترات) عن إدخالها في السدادات…
أكمل القراءة » -
السلامة في المختبرات الكيميائية
تحذيرات للطلاب في المختبرات الكيميائية – يجب قبل البدء في العمل المخبري أن نعي أهمية وخطورة المواد المستخدمة. وأخذ الحيطة…
أكمل القراءة » -
تحميل كتاب التحليل الحجمي والوزني – الجزء العملي
– استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام.، نقدم لكم اليوم كتاب غاية فى الروعة وهو…
أكمل القراءة »