الكيمياء التحليلية تهتم بدراسة تركيب المواد وتحديد مكوناتها. تشمل التحليل الكيفي والكمي، وتُستخدم في المختبرات والصناعات لتحديد نقاء المواد واكتشاف العناصر والمركبات بدقة.
الكيمياء التحليلية
-
تحميل كتاب المصطلحات الكيميائية pdf
استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام. نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
تحميل كتاب الماء وتقنية مياة الصرف pdf
استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام. نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
تحميل كتاب مفتاح الإبداع في الكيمياء التحليلية
استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
تحميل كتاب الكيمياء الجنائية pdf
الكيمياء الجنائية Forensic Chemistry تعد الكيمياء الجنائية Forensic Chemistry واحدة من أهم علوم الأدلة الجنائية المكملة لبقية علوم الأدلة الأخرى،…
أكمل القراءة » -
حموضة الاحماض وقاعدية القواعد
حموضة الاحماض وقاعدية القواعد – في هذا الموضوع سوف نتكلم عن حموضة الاحماض وقاعدية القواعد وكيف يمكن التفرقة بين الأحماض…
أكمل القراءة » -
جهاز مطياف تحويل فورييه بالأشعة تحت الحمراء FT-IR Spectrometer
في هذا الموضوع بأذن الله سوف نتكلم عن جهاز مطياف تحويل فورييه بالأشعة تحت الحمراء وكل ما يتعلق به. Double beam…
أكمل القراءة » -
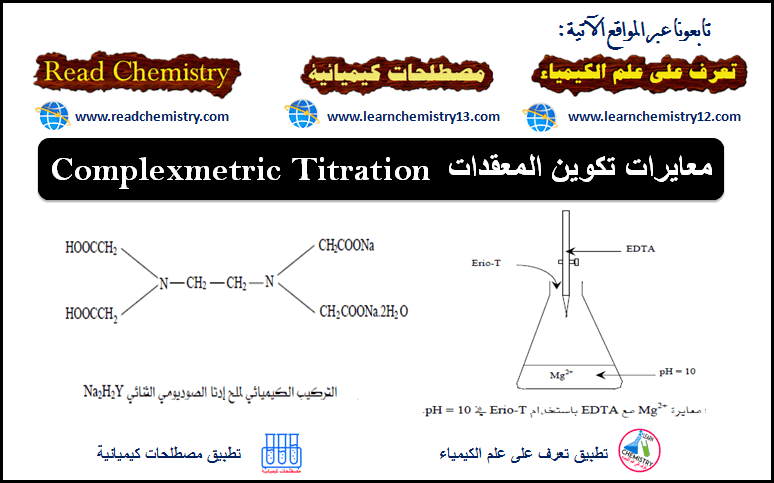
معايرات تكوين المعقدات Complexmetric Titration
المعقد التناسقي Coordination complex هو عبارة عن بنية كيميائية تتألف من ذرة مركزية أو أيون واحد غالباً أو أكثر، والتي…
أكمل القراءة » -
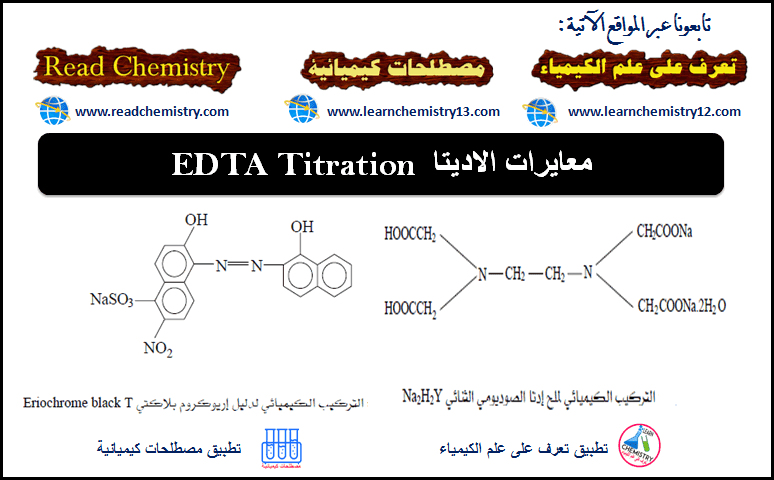
معايرات الاديتا EDTA Titration
معايرات تكوين المعقدات (المتراكبات) التي تستخدم فيها الأديتا EDTA (1) يعتبر EDTA حمضاً عضوياَ ضعيفاَ وهو من أهم عوامل التعقيد المستخدمة في المعايرات التى…
أكمل القراءة » -
تفاعلات تكوين المعقدات Complex Formation reactions
فكرة عامة عن تكوین الأيونات المعقدة Complex-ion Formation – تمیل بعض أیونات الفلزات وخاصة العناصرالانتقالية منها الى الارتباط بواحد أو…
أكمل القراءة » -
تعيين عيارية وقوة HCl , NaCl في مخلوط منهما باستخدام AgNO3
الأساس النظري (1) تتم معایرة حمض الهیدروكلوریك HCl فقط باستخدام محلول قياسي من هيدروكسيد الصوديوم NaOH ویتم تعیین حجم هیدروكسید الصودیوم…
أكمل القراءة » -
تعيين عيارية NaCl باستخدام محلول قياسي من AgNO3 – طريقة فولهارد
في هذا الموضوع سيتم تعیین عیاریة وقوة كلورید الصودیوم بواسطة محلول قياسي من نترات الفضة باستخدام طريقة فولهارد Volhard’s…
أكمل القراءة » -
تعیین عیاریة AgNO3 باستخدام محلول قياسي NaCl بطريقة موهر و فاجان
في هذا الموضوع سيتم تعیین عیاریة وقوة نترات الفضة باستخدام محلول قياسي من كلوريد الصوديوم وذلك بطريقتين: (أ)…
أكمل القراءة » -
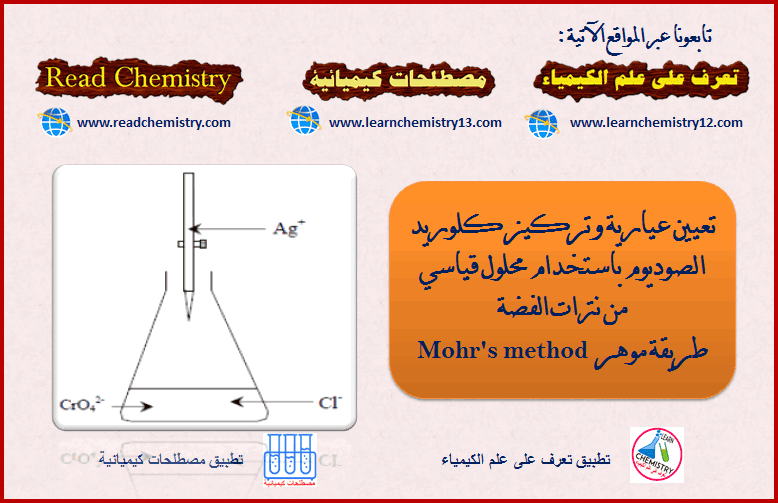
تعيين عيارية NaCl باستخدام محلول قیاسي من AgNO3 (طريقة موهر)
طريقة موهر Mohr’s method – طريقة موهر هي أحدى الطرق المستخدمة لتحديد نقطة النهاية في معايرات الترسيب (طرق القياس الفضي). – يستخدم…
أكمل القراءة » -
طرق تحديد نقطة النهاية في معايرات الترسيب
معايرات الترسيب Precipitation titrations – في هذا النوع من المعايرات والذي يسمكى بمعايرات الترسيب يكون أحد نواتج التفاعل شحيح…
أكمل القراءة » -
منحنيات معايرات الترسيب Curves of Precipitation Titrations
معايرات الترسيب Precipitation Titrations – معايرات الترسيب: يتم في هذا النوع من المعايرة تفاعل بين المادة المراد تعيينها وبين المحلول…
أكمل القراءة » -
الطرق المستخدمة في معايرات الترسیب Precipitation Titrations
معايرات الترسيب Precipitation titrations – في معايرات الترسیب يكون أحد نواتج التفاعل شحيح الذوبان في الماء مكوناً راسب ويرمز لهذا…
أكمل القراءة » -
تحميل كتاب التطبيقات العملية في التحاليل الكيميائية الآلية وطرائق الفصل
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة » -
تحميل كتاب تجارب فى التحليل الآلي تأليف/ عادل عباس – تركي الصالح
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
تجربة تقدیر مولاریة ثيوكبريتات الصوديوم باستخدام يودات البوتاسيوم النقية
تجربة تقدیر مولاریة ثيوكبريتات الصوديوم باستخدام يودات البوتاسيوم النقية تقدیر مولاریة وتركيز ثيوكبريتات الصوديوم Na2S2O3 باستخدام محلول قياسي من يودات البوتاسيوم…
أكمل القراءة » -
تجربة تقدير تركيز أيونات الحديد الثنائي والحديد الثلاثي في عينة ما
عنوان التجربة تحليل خليط من أيونات الحديد الثنائي (Fe+2) والحديد الثلاثي (Fe+3) باستخدام محلول قياسي من ثاني كرومات البوتاسيوم K2Cr2O7 تركيزه 0.05 مول/لتر…
أكمل القراءة »