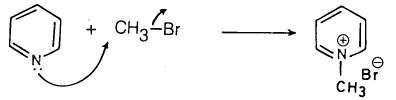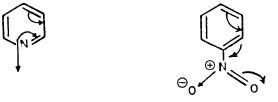تفاعلات البريدين Pyridine reactions – الخواص الكيمبائية
في الموضوعات السابقة تم مناقشة مركب البريدين Pyridine (طرق تحضير البريدين ومشتقاته – الخواص الفيزيائية). وفي هذا الموضوع سيتم مناقشة جميع تفاعلات البريدين المعروفة.
محتويات الموضوع
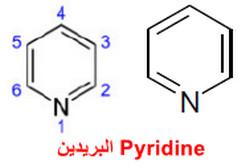
ما هو مركب البريدين Pyridine؟
– البريدين هو مركب أروماتي عطري يتكون من حلقة سداسية تشبه البنزين تحتوي على ذرة واحدة غير متجانسة وهي ذرة النيتروجين.
– التركيب الكيميائي له كما بالشكل التالي:
– ومن المعروف أن البريدين مركب عطري. وهو يشبه البنزين إلى أبعد الحدود إلا أنه أقل طاقة تأرجحية وأقل استقراراً تجاه بعض التفاعلات الكيميائية.
– بالإضافة إلى أن عدد متشكلات البريدين أكثر من تلك التي للبنزين. وتعرف الكاتيونات التي تشتق من البريدين بالبريدنيوم (Pyridinium).
الخواص الكيمائية للبريدين Chemical properties of pyridine
– من دراسة الخواص الفيزيائية والتركيب للبريدين ثبت أنه مركب أروماتي على درجة كبيرة من الثبات. وهو يشبه البنزين إلى حد كبير.
– من ناحية أخرى فإن للبريدين خواص قاعـدية حيث إنه يستطيع أن يكون أملاحاً ثابتة لا يؤثر تكونها على خواصه الأروماتية. وذلك لأن الإلكترونات الحرة على ذرة النتروجين، والتي تكسبه الصفة القاعدية لا تدخل في تكوين الخاصة الأروماتية للبريدين.
– لذلك يستخدم البريدين كمذيب وقاعدة لبعض التفاعلات التي يتكون فيها حمض كناتج جانبي.
– على العموم فإن البريدين يقوم بتفاعلات عديدة منها:
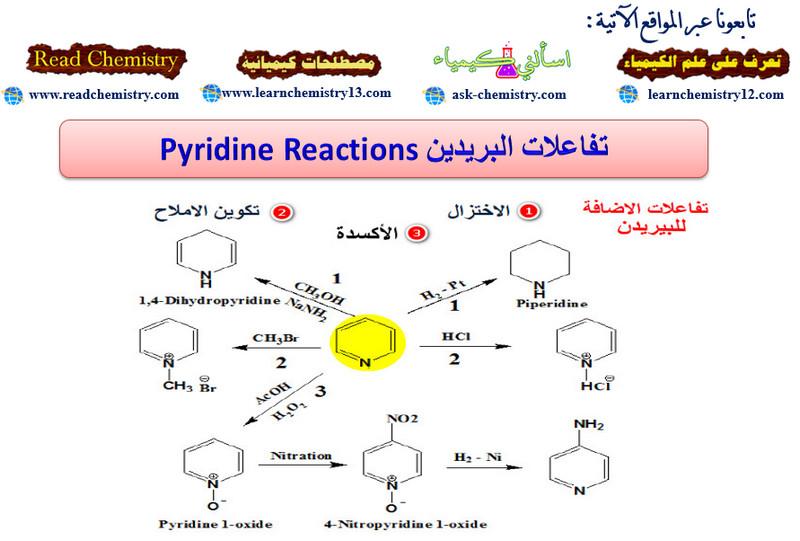
تفاعلات البريدين Pyridine reactions
أولاً/ تفاعلات الإضافة Addition reaction
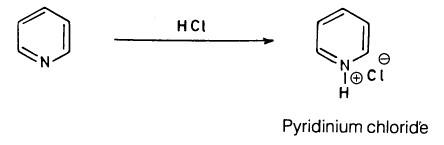
(1) تفاعل البريدين مع الأحماض
حيث إن زوج الإلكترونات الحر على ذرة النيتروجين لا يشترك في تكوين السحابة الإلكترونية. فإن هذا يجعل البريدين يتفاعل مع الحموض القوية كقاعدة ضعيفة حيث تبلغ pka له (23 , 5).
– تتكون نتيجة لذلك أملاح قابلة للذوبان في الماء تسمى بأملاح البريدنيوم. كما أن له بعض الأملاح مثل PyH-HgCl3 وغيرها شحيحة الذوبان في الماء.
– وكما ذكرنا سابقاً، فإن تكوين مثل هذه الأملاح لا يحطم الخواص الأروماتية للحلقة.
– ومن تفاعلات الإضافة التي يقوم بها البريدين تفاعله مع الأحماض كما في المعادلة الآتية:
وعنـد تسخين البريدين مع HCl عند درجة حرارة 300مo فإن هذا يؤدي إلى تحطيم حلقة البريدين والحصول على الميثان والأمونيا.
ولخاصيته القاعدية فوائد كثيرة فهو يستعمل كمذيب لبعض التفاعلات يتكون فيها حمض قوي كناتج جانبي. ولذلك يتم التخلص من ذلك الحمض عن طريق تفاعله مع البريدين وتحويله إلى ملح.
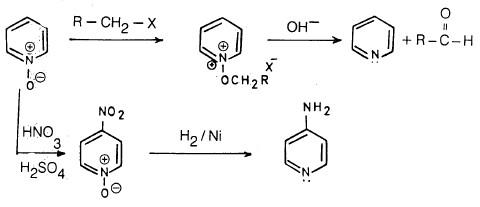
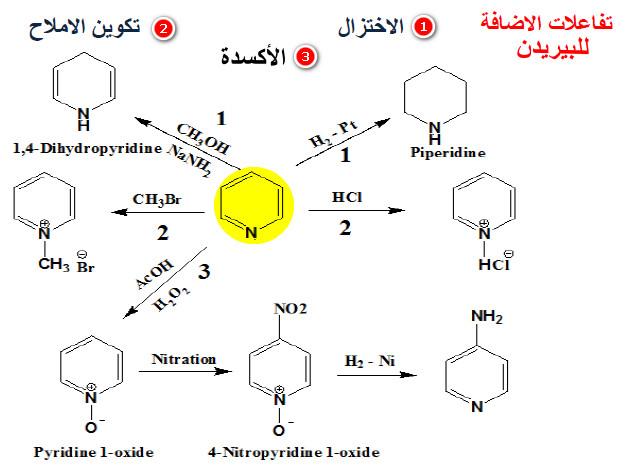
(2) تفاعل البريدين مع هاليدات الألكيل
وبالإضافة إلى ما سبق فأن البريدين يستطيع أن يتفاعل مع هاليدات الألكيل وتكوين أملاح رباعية يمكن عزلها أحياناً أو تحديد وجودها كمادة وسيطة.
– ومثل ذلك تفاعله مع بروميد الميثيل حيث يتكون 1ـ ميثيل بریدنیوم بروماید.
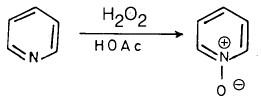
(3) أكسدة البريدين Oxidation of pyridine
ومن جهة أخرى يمكن أكسدة البريدين بواسطة الحموض فوق الأكسيجينية إلى 1- أوكسيد أو N-أوكسيد. وهذا المركب يعتبر ملحاً داخلياً (Internal pyridinium salt)
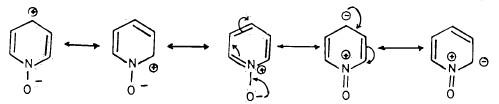
وهذا له أشكال تأرجحية (رنينية) عديدة تجعله أكثر ثباتاً من أملاح البريدينيوم العادية. ويمكن تمثيل هذه الأشكال التأرجحية كالتالي :
– ومن هذه الأشكال التأرجحية يمكن ملاحظة أن الكثافة الإلكترونية يمكن أن تكون عالية أو منخفضة عند موضعي (2) أو (4). ولذلك فإن أكسيد البريدين أكثر فعالية تجاه العوامل الإلكترو فيلية والنيكلوفيلية وغالباً ما يتم الاستبدال عند موضع (4).
– وبما أن ذرة الأكسجين يمكن إزالتها بسهولة فإن هذا المركب يمكن أن يستخدم في تحضير كثير من المركبات التي يصعب تحضيرها بالطرق الأخرى. ومن الأمثلة على ذلك:
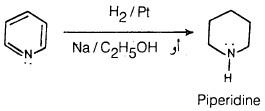
(4) اختزال البريدين Reduction of pyridine
– ومما يجدر ذكره أنه يمكن اختزال البريدين إلى الببيريدين بواسطة الهيدروجين ووجود عامل مساعد مثل النيكل أو البلاتين.
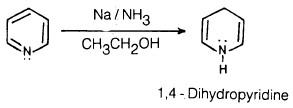
– كذلك يمكن اختزال البريدين بواسطة الصوديوم في الكحول.
– البريدين مركب سائـل يـغـلي عند درجة حرارة 106°م وله خواص الأمين الثانوي أما اختزال البريدين بواسطة الصوديوم في وسط من الأمونيا وفي وجود الإيثانول ( Birch reduction) فإنه يؤدي إلى اختزال جزئي حيث نحصل على 4.1- ثنائي هیدروبریدین كما بالمعادلة التالية:
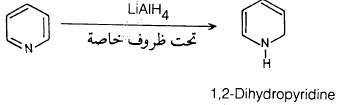
– أما مع LiAlH4 فإنه يؤدي إلى الحصول على 2.1- ثنائي هيدروبريدين في حالة وجود ظروف معينة وإلا فإنه يتم الحصول على الببيريدين.
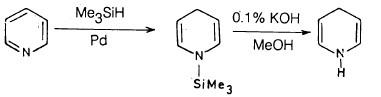
– يمكن اختزال البريدين بطرق أخـرى مثل استخدام ثلاثي مثيل السليكون في وجـود عامـل مسـاعـد مثـل البلاديوم ثم معاملة الناتج بهيدروكسيد البوتاسيوم الكحولي:
(5) تفاعل البريدين مع الهالوجينات
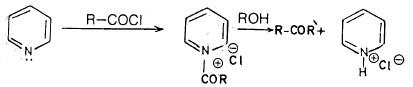
ومن تفاعلات الإضافة الأخرى أن البريدين يستطيع أن يتفاعل مع الهالوجينات عند درجة الحرارة العادية ويكون ۱ـ هالوبريدنيوم هاليد مثل –C5H5N+ Br Br ومع كلوريد الأسيل ( (Acyl chloride) ليكون 1- أسيل بريدنيوم كلورايد ويعتقد أن هذا هو المركب النشط في تفاعلات أسيلة مجموعة الهيدروكسيل والأمين في تفاعلات الاسترة مثلاً.
وهذا النوع من المركبات الرباعية يعتقد أنها المركبات النشطة عندما يستخدم حمض الخل اللامائي كمادة للأسيلة والبريدين كمذيب.
ويمكن تلخيص تفاعلات الإضافة فى الشكل التالي:
ثانياً/ تفاعلات الاستبدال الإلكتروفيلية Electrophilic substitution
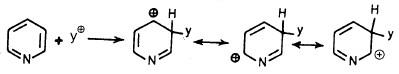
– عندما نتفحص الأشكال التأرجحية للبريدين ونراجع حسابات المدارات الذرية نجد أن:
الكثافة الإلكترونية أكثر ما تكون على موضعي (3) و (5) ولذلك فإن الكواشف الإلكتروفيلية تفضل هذين الموضعين.
بينما المواقع (2) و(4) و(6) تكون أقل كثافة إلكترونية وعليه فإن الهجوم بواسطة العوامل النيكلوفيلية يفضل هذه المواضع.
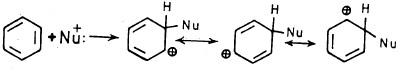
– كل ذلك بسبب وجود ذرة النيتروجين ذات الكهروسالبية الأكبر من تلك التي للكربون مما يجعله يسحب الإلكترونات الحلقة باتجاهه وهذا يثبط نشاط الحلقة تجاه العوامل الإلكتروفيلية وهذا يشبه إلى حد ما، ما يحدث في مركب نيتروبنزين كما يتبين ذلك من الأشكال التالية:
وعنـدمـا يـتـفـاعـل البريدين مع الحموض ويكون ملحاً أي عندما تكون ذرة النيتروجين ذات شحنة موجبة فإن هذا يزيد من تثبيط الحلقة وهذا بالطبع ينعكس على التفاعلات الإلكتروفيلية مع البريدين مثل النيترة والسلفنة.
– وعلى أية حال عندما توجد مجموعة معطية للإلكترونات على حلقة البريدين فإن هذا يساعد على التفاعلات الإلكتروفيلية.
- وعند وجود المجموعة البديلة في موضع (3) فإن المجموعة المهاجمة تدخل موضعي (2) و(6)
- وإذا كانت المجموعة البديلة في موضع (2) أو (4) فإن المجموعة المهاجمة تدخل موضعي (3) و(5)
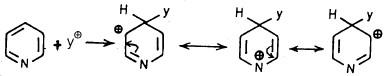
– ويمكن توضيح ذلك عن طريق دراسة مدى استقرار الكربوكاتيون المتكون كناتج متوسط على شكل معقد.
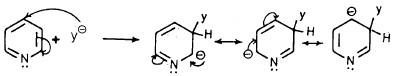
– فعلى سبيل المثال هناك ثلاثة أشكال تأرجحية عند حدوث الاستبدال في موضع (2) أو (3) أو (4) إلا أنه عند الاستبدال في موضعي (2) أو (4) نجد أن أحد هذه الأشكال التأرجحية توجد فيه الشحنة الموجبة على ذرة النيتروجين وهذا يجعل الجزيء أقل استقراراً بالمقارنة مع الأشكال التأرجحية الناتجة عن الاستبدال في موضع (3). وهذا يمكن تمثيله كما يلي:
- عند الاستبدال الإلكتروفيلي في موضع (2).
- عندما يحدث الاستبدال الإلكتروفيلي في موضع (4).
- عندما يحدث الاستبدال الإلكتروفيلي في موضع (3).
– وهذه التراكيب أقل ثباتاً من التراكيب التأرجحية للبنزين والناتجة عن مهاجمة العامل الإلكتروفيلي لحلقة البنزين والموضحة فيما يلي:
– ومن أهم تفاعلات الاستبدال الإلكتروفيلية:
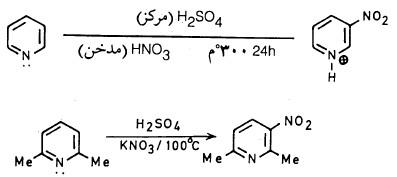
(1) نيترة البريدين Nitration of Pyridine
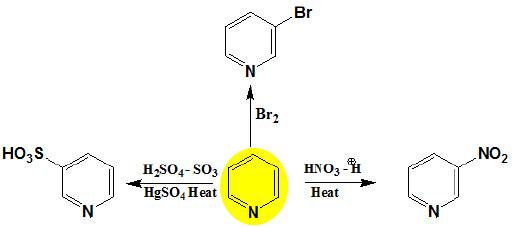
– کما سبق وأشرنا بأن حلقة البريدين غير نشطة تجاه العوامل الإلكتروفيلية، هذا يتضح بصورة جلية عند نيترة البريدين حيث يحتاج ذلك إلى ظروف قاسية تتمثل باستخدام حمض الكبريتيك المركز وحمض النيتريك المدخن والتسخين إلى درجة حرارة عالية تصل إلى 300°م حيث نحصل على 3- نيتروبريدين.
– إلا أن عملية النيترة تسهل في وجود مجموعات معطية للإلكترونات على الحلقة مثل المجاميع الألكيلية.
أما الحصول على مجموعة نيترو في موضعي (2) أو (4) فيتم عن طريق أكسدة مجمـوعـة الأمين في أي من هذين الموضعين إلى مجموعة نيترو بواسطة فوق أكسيد الهيدروجين في حمض الكبريتيك.
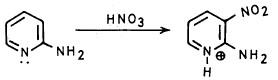
– وعموماً يمكن أن تتم عملية نيترة البريدين بكل سهولة بواسطة حمض النيتريك عندما توجد مجاميع معطية للإلكترونات مثل مجموعة الأمين أو الهيدروكسيل.
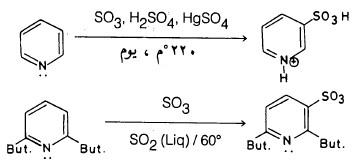
(2) سلفنـة البريدين Sulphonation of Pyridine
– كما هو الحالة في عملية النيترة تجد أن سلفنة البريدين صعبة جداً إلا أن عملية السلفنة تتم عند التسخين إلى درجة حرارة 220 مo في وجـود 20٪ أوليوم (Oleum) يحتوي على نسبة من كبريتات الزئبقيك مع حمض الكبرتيك وثالث أوكسيد الكبريت . ويكون مردود التفاعل أعلى إذا وجدت مجاميع الكيلية على حلقة البريدين.
ويتم الاستبدال في موضع (3) حيث نحصل على بريدين -3- حمض السلفونيك بنسب تصل إلى 70%
– أما إدخال مجموعة حمض السلفونيك إلى موضع (2) أو (4) فيتم عن طريق أكسدة مجموعة SH- في أي من هذين الموضعين.
وعلى العموم فإن العامل الإلكتروفيلي المهاجم يقوم بالهجوم على البريدين الذي يحمل شحنة موجبة أي بعد انضمام البروتون إلى ذرة نيتروجين البريدين في الوسط الحمضي.
(3) تفاعل فريدل كرافتز Friedel-Crafts reaction
– هذا التفاعل لا يتم مع البريدين وقد فشلت جميع المحاولات ويعتقد أن السبب في ذلك أن البريدين يشكل معقداً مع حموض لويس مثل FeCl3 , AlCl3 بالإضافة إلى ضعف العامل الإلكتروفيلي المهاجم وعدم فعالية البريدين.
(4) هلجنـة البريدين Halogenation of Pyridine
(أ) برومة البريدين
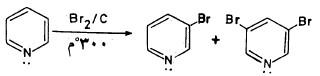
– تتم عملية الهلجنة عند شروط قاسية فعلى سبيل المثال يمكن برومة البريدين عندما يمرر البروم على عامل مساعد مثل الفحم عند درجة حرارة 300مo ، ويتم الحصول على خليط من 3- بروموبريدين و5.3- ثنائي بروموبريدين
– وهذا يعتبر تفاعلًا إلكتروفيلياً أما إذا تم التفاعل عند درجة حرارة عالية 500°م فإنه يتم عن طريق الشقوق الحرة ونحصل على استبدال في موضع (2) أو (4) أو (6).
(ب) كلورة البريدين
– أمـا الكلورة فإنها تتم بصـورة غير مباشرة أو بوجود عامل مساعد حيث يتم الحصول على 3ـ كلوروبريدين بواسطة التفاعل مع الكلور في وجود جزيئين من كلوريد الألومنيوم.
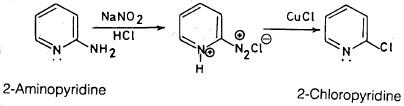
– أما 2- و4ـ كلوروبريدين فيتم الحصول عليها عن طريق تفاعلات الدستزة ( Diazotization) أي تحويل مجموعة الأمين إلى ملح ديازونيوم ومفاعلة هذا الأخير مع كلوريد النحاسوز مع العلم أن هذه الطريقة تتم بصعوبة في حالة 2- أمينوبريدين وهي سهلة في حالة 3- أمينوبريدين .
ويمكن تلخيص تفاعلات الاستبدال الإلكتروفيلية للبيريدين كما بالشكل التالي:
ثالثاً/ تفاعلات الاستبدال النيكلوفيلية Nucleophilic substitution
– يعتبر البريدين نشطاً تجاه العوامل النيكلوفيلية القوية وذلك لأن ذرة النيتروجين ذات الكهروسالبية العالية تعمل على سحب الإلكترونات من حلقة البريدين وهذا يزيد من تمركز الشحنة الموجبة بصورة كبيرة في كل من موضعي 6, 4 ,2 مما يجعلها أكثر عرضة للهجوم بواسطة العوامل النيكلوفيلية.
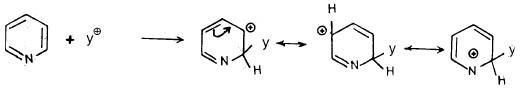
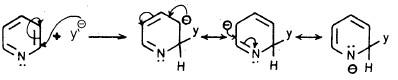
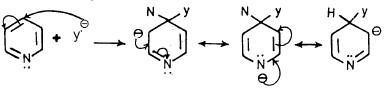
وعلى العموم فإنه عند هجوم العامل النيكلوفيلي على موضعي 2 أو 4 نجد أن الكاربانيون الناتج على شكل معقد (δ) له ثلاثة أشكال تأرجحية تكون الشحنة السالبة في واحد منها متمركزة على ذرة النيتروجين. وعليه فإن هذه الأنيونات تكون أكثر ثباتاً من تلك التي تنتج من مهاجمة العامل النيكلوفيلي على موضع (3) كما يتبين ذلك من الأشكال التأرجحية التالية:
- عندما يتم الهجوم النيكلوفيلي عند موضع (2).
- وعندما يتم الهجوم النيكلوفيلي عند موضع (4).
- عندما يتم الهجوم النيكلوفيلي في موضع (3).
وبذلك يتضح أن العامل النيكلوفيلي يفضل 2 و4 و6 على مواضع 3 و5.
– وعـلى العموم فإن جميع هذه التراكيب أكثر ثباتا من التراكيب المطابقة لها عند هجوم العامل النيكلوفيلي على حلقة البنزين أو أحد مشتقاتها وبذلك يتضح أن وجود ذرة النيتروجين هو السبب في جعل البريدين غير فعال تجاه العوامل الإلكتروفيلية ونشطا تجاه العوامل النيكلوفيلية.
ومن أهم تفاعلات الاستبدال النيكلوفيلية للبريدين التفاعلات التالية:
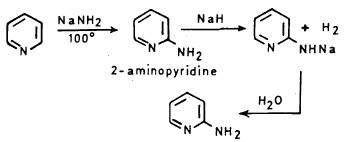
(1) تفاعل البريدين مع القواعد القـوية
يمكن إدخال مجمـوعـة الأمين أو الهيدروكسيل لحلقة البريدين. وذلك عن طريق تفاعله مع القواعد القـوية مثـل أميد الصوديوم NaNH2 عنـد درجة حرارة 100مo. حيث يتكون ملح صوديومي يعامل بالماء ليعطي 2- أمينوبريدين أما عند وجود زيادة من NaNH2 فإننا نحصل على ٦,٢- ثنائي أمينوبريدين.
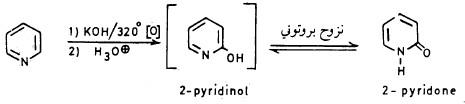
كذلك يتفاعل مع هيدروكسيد البوتاسيوم عند درجة حرارة 320مo في وجود الأكسجين، حيث يتم الحصول على 2ـ هيدروكسي بريدين والذي يكون في وضع اتزان ليشكل 2- بریدون .
(2) تفـاعـلات الألكلة والأزيلة
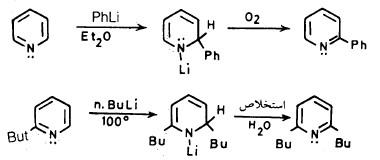
– يتفـاعـل البريدين مع الكيلات الليثيوم بخطوتين الأولى عبارة عن تفاعل إضافة للمركب العضو معدني بصورة سريعة حيث يعطي ملح بريدين ليثيوم مشبع جزئياً ( Dihydropyridine) وهذا يمكن عزله في بعض الأحيان .
كذلك يمكن أكسدة هذا الملح إلى البريدين الأروماتي وذلك إما بإضافة عامل مؤكسد أو عن طريق التسخين في وجود الماء كما يتبين ذلك من المعادلات الآتية:
(3) تفاعل البريدين مع الصوديوم
كما أن البريدين يتفاعل مع الصوديوم ويعطي عدداً كبيراً من النواتج معتمداً بذلك على ظروف التفاعل. ويعتقد أن هذا التفاعل يبدأ أولاً بطريق الشقوق الحرة.
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان. والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة. Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني