الكيمياء العامة
الكيمياء العامة تُعد أساس فروع الكيمياء، تدرس المادة وخواصها وتغيراتها. تشمل الذرات، الجزيئات، التفاعلات، والمعادلات. تساعد في فهم الظواهر الطبيعية وتطبيقات العلوم في الحياة اليومية.
-
أختبار على المركبات الأيونية والفلزات
أختبار على المركبات الأيونية والفلزات في هذا الموضوع نقدم لك أختبار على المركبات الأيونية والروابط الأيونية والفلزات. وهو أختبار…
أكمل القراءة » -
معلومات هامة جداً عن عنصر التيتانيوم Titanium
ما هو عنصر التيتانيوم Titanium؟ التيتانيوم عنصر من عناصر الجدول الدوري: العدد الذري = 22، العدد الكتلي = 48 –…
أكمل القراءة » -
أختبر نفسك في الجدول الدوري
أختبر نفسك في الجدول الدوري في هذا الموضوع نقدم لك أختبار في الجدول الدوري والتدرج في خواص العناصر. وهو أختبار…
أكمل القراءة » -
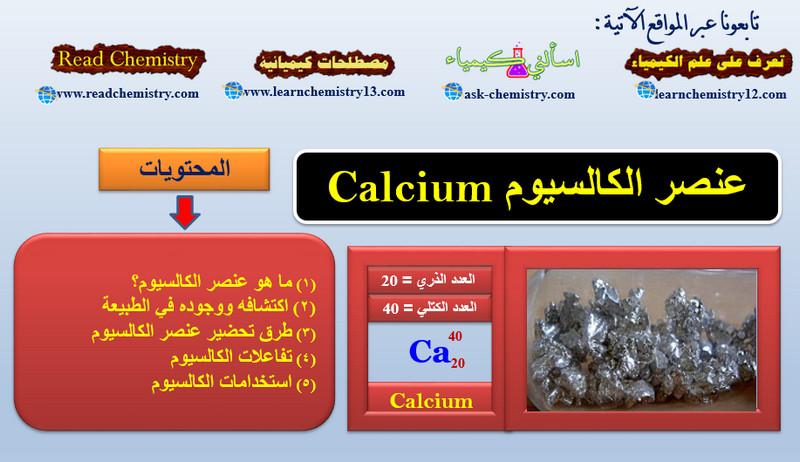
معلومات هامة جداً عن الكالسيوم Calcium
ما هو عنصر الكالسيوم Calcium؟ – الكالسيوم Ca هو عنصر من عناصر الجدول الدوري: العدد الذري = 20 ، العدد…
أكمل القراءة » -
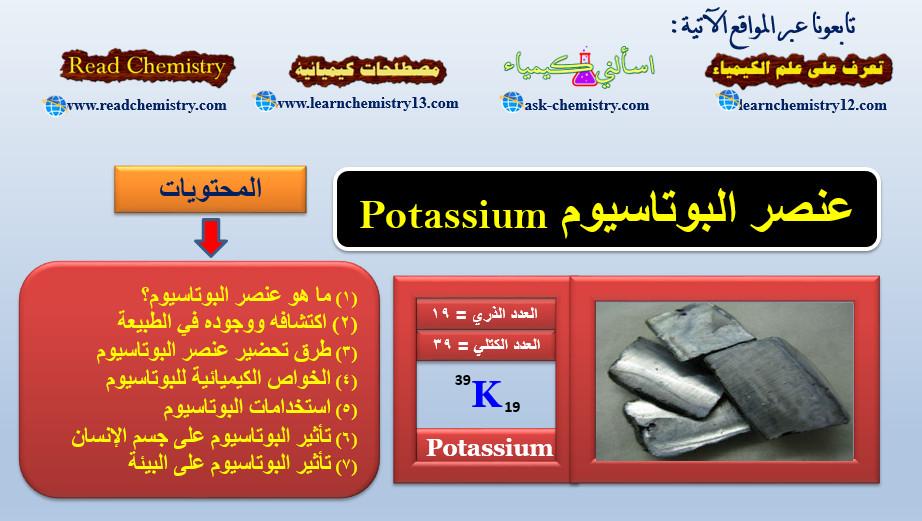
معلومات هامة جداً عن عنصر البوتاسيوم Potassium
ما هو عنصر البوتاسيوم Potassium؟ – هو عنصر من عناصر الجدول الدوري: العدد الذري = 19، العدد الكتلي = 39…
أكمل القراءة » -
معلومات هامة جداً عن غاز الأرجون Argon gas
ما هو غاز الأرجون Argon gas؟ – الأرجون عنصر من عناصر الجدول الدوري: العدد الذري = 18، العدد الكتلي =…
أكمل القراءة » -
أختبار قوانين الغازات Gases laws Exam
أختبر نفسك في قوانين الغازات في هذا الموضوع نقدم لك أختبار قوانين الغازات وهو أختبار بسيط لقياس مدى قوة…
أكمل القراءة » -
أختبار الأحماض والقواعد Acid – Base Quiz
أختبر نفسك في تعاريف الأحماض والقواعد في هذا الموضوع نقدم لك أختبار الأحماض والقواعد وهو أختبار بسيط لقياس مدى…
أكمل القراءة » -
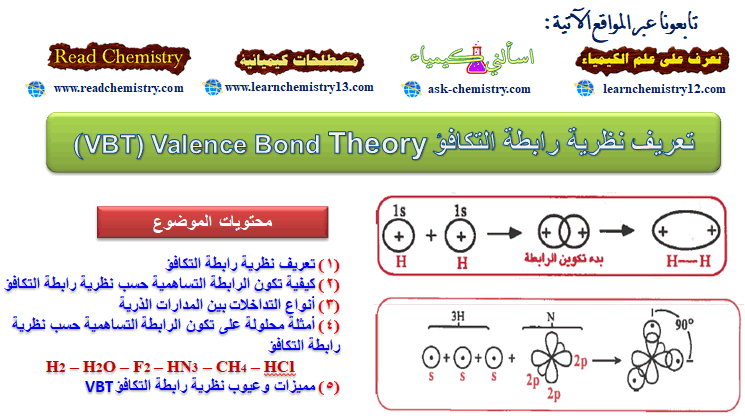
نظرية رابطة التكافؤ (VBT) Valence Bond Theory
نظريات تفسير تكون الروابط التساهمية لجا العلماء إلى ميكانيكا الكم لتفسير كيفية تكون الرابطة التساهمية فظهر نتيجة لذلك نظريات توضح وتفسر…
أكمل القراءة » -
حموضة الاحماض وقاعدية القواعد
حموضة الاحماض وقاعدية القواعد – في هذا الموضوع سوف نتكلم عن حموضة الاحماض وقاعدية القواعد وكيف يمكن التفرقة بين الأحماض…
أكمل القراءة » -
معلومات هامة عن غاز الكلور Chlorine gas
في هذا الموضوع سوف نستعرض أهم مميزات غاز الكلور وخواصه أولاً: ما هو عنصر الكلور؟ What is Chlorine element – الكلور…
أكمل القراءة » -
وحدات القياس و الثوابت الفيزيائية والكيميائية التى تحتاجها فى دراستك
في هذا الموضوع سوف نستعرض أهم وحدات القياس المستخدمة فى الفيزياء والكيمياء وكذلك أهم الثوابت الفيزيائية والكيميائية التى تحتاجها أثناء…
أكمل القراءة » -
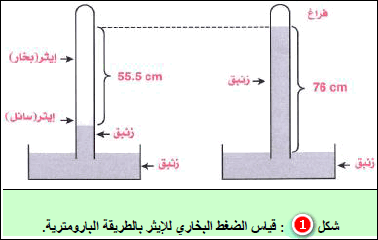
قياس الضغط البخاري Measurement of Vapour Pressure
تعريف الضغط البخاري Vapour Pressure – هو الضغط الناتج من جزیئات بخار السائل الموجود في وعاء مغلق . – لكل سائل…
أكمل القراءة » -
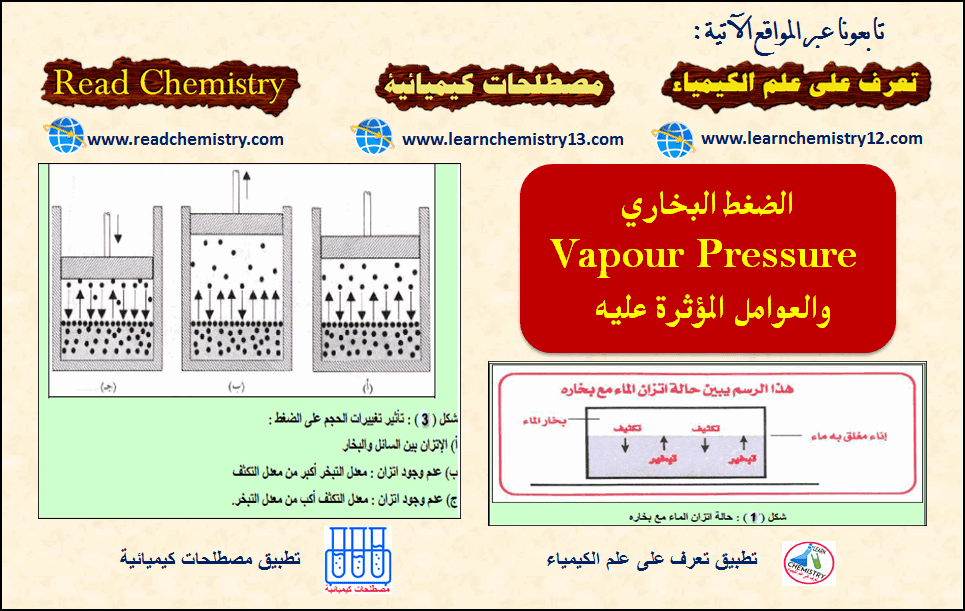
الضغط البخاري Vapour Pressure والعوامل المؤثرة عليه
ضغط بخار السائل Liquid Vapour Pressure – الضغط البخاري لكل من الصلب والسائل ھو مقیاس لمیل المادة للتبخیر. – فلو…
أكمل القراءة » -
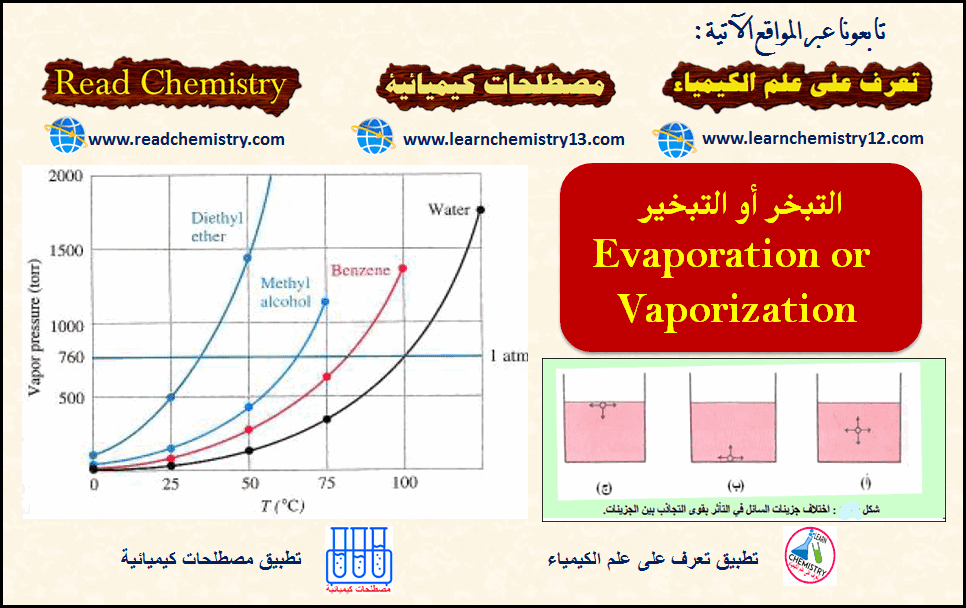
التبخر أو التبخير Evaporation or Vaporization
تبخر السائل Vaporization of liquid – نعرف جمیعاً أن الملابس المبللة بالماء، عند تعلیقھا في الھواء، تفقد ما بھا من…
أكمل القراءة » -
قوى التجاذب بين جزئيات السائل Intermolecular Forces
توجد قوى التجاذب بين جزئيات السائل وتكون أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء، فمثلاً الطاقة…
أكمل القراءة » -
قوى لندن التشتتية London Dispersion Forces (قوى فان درفالز)
هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء،…
أكمل القراءة » -
مسائل محلولة على خواص الغازات Gas Properties – الجزء الثاني
يمكنك متابعة الجزء الأول من مسائل محلولة على خواص الغاز المثالي من خلال هذا الرابط : الجزء الأول مثال (11):…
أكمل القراءة » -
مسائل محلولة على خواص الغازات Gas Properties – الجزء الأول
فى هذا الموضوع سوف نتطرق إلى (10) مسائل محلولة عن خواص الغازات بأفكار مختلفة وحلول بسيطة وطرق سهلة. كما تم…
أكمل القراءة » -
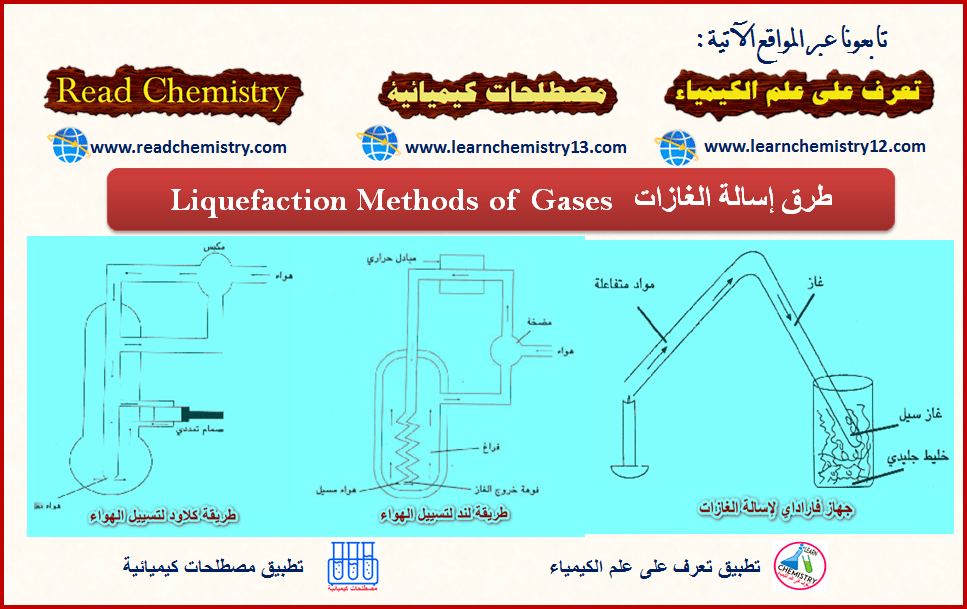
طرق إسالة الغازات Liquefaction Methods of Gases
طرق إسالة الغازات Liquefaction Methods of Gases – تختلف السوائل عن الغازات في تعبیر القوى المتبادلة بین الجزیئات، ومتوسط الممر الحر…
أكمل القراءة »