الكيمياء العامة
الكيمياء العامة تُعد أساس فروع الكيمياء، تدرس المادة وخواصها وتغيراتها. تشمل الذرات، الجزيئات، التفاعلات، والمعادلات. تساعد في فهم الظواهر الطبيعية وتطبيقات العلوم في الحياة اليومية.
-
اشتقاق المعادلة الحركية للغازات Kinetic Equation of Gases
في هذا الموضوع بإذن الله سوف نتناول كيفية اشتقاق أو استنتاج المعادلة الأساسية للنظرية الحركية Fundamental Equation of the Kinetic…
أكمل القراءة » -
مناقشة فروض النظرية الحركية الجزيئية للغازات
تكلمنا في الموضوع السابق عن فروض النظرية الحركية الجزيئية للغازات Assumptions of Molecular Kinetic Theory of Gases . وفى هذا…
أكمل القراءة » -
فروض النظرية الحركية الجزيئية للغازات Kinetic Theory of Gases
النظرية الحركية الجزيئية للغازات Molecular Kinetic Theory of Gases – تساعد قوانین الغازات في التنبؤ بسلوك الغازات. ولكنھا لا تفسر…
أكمل القراءة » -
عنصر الأكسجين Oxygen (اكتشافه – تحضيره – خواصه – استخداماته)
أولاً/ ما هو عنصر الأكسجين Oxygen ؟ – الأكسجين Oxygen هو أحد أهم العناصر الكيميائية الموجودة في الجدول الدوري للعناصر…
أكمل القراءة » -
مسائل محلولة على قانون جراهام للتدفق والانتشار
كنا قد تناولنا في الدرس السابق شرح قانون جراهام للتدفق والانتشار Graham’s Law of Diffusion and Effusion وفى هذا الدرس…
أكمل القراءة » -
قانون جراهام للتدفق والانتشار Graham’s Law of Diffusion and Effusion
أولاً/ الفرق بين التدفق (Effusion) والانتشار (Diffusion) – یلزم التفریق بین مصطلحین ھما الإنتشار (Diffusion) والتدفق (الإنبجاس) .(Effusion) – من…
أكمل القراءة » -
مسائل على قانون دالتون Dalton Law للضغوط الجزيئية (الجزء الثاني)
كنا قد تناولنا في الدرس السابق مجموعة من المسائل المحلولة عن قانون دالتون للضغوط الجزيئية Dalton Law وعددها 11 مسألة…
أكمل القراءة » -
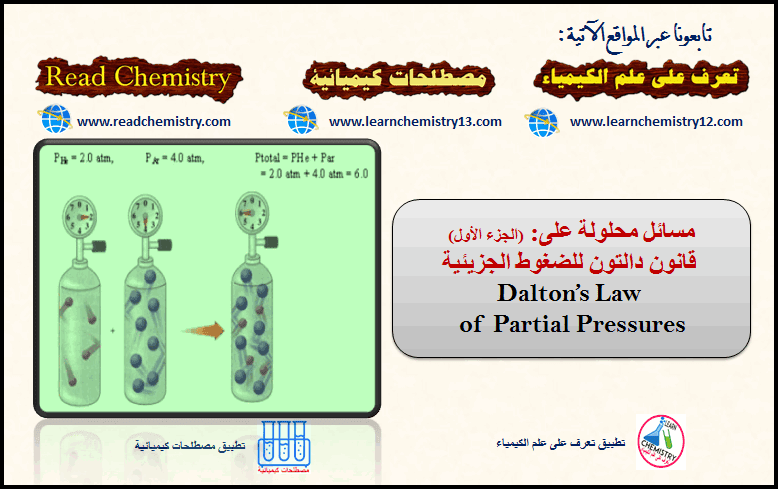
مسائل على قانون دالتون Dalton’s Law للضغوط الجزيئية (الجزء الأول)
تكلمنا في الدروس السابقة عن قانون دالتون للضغوط الجزيئية Dalton’s Law of Partial Pressure (يمكنك مراجعة الدرس من خلال هذا الرابط).…
أكمل القراءة » -
النيتروجين Nitrogen – معلومات هامة جداً عن النيتروجين
أولاً/ ما هو عنصر النيتروجين؟ – النيتروجين عنصر من عناصر الجدول الدوري العدد الذري = 7، العدد الكتلي = 14…
أكمل القراءة » -
عنصر البورون Boron
أولاً: ما هو عنصر البورون؟ ** البورون B عنصر من عناصر الجدول الدوري العدد الذري=5 ، العدد الكتلي= 10 ** التوزيع…
أكمل القراءة » -
تحميل أطلس العلوم بالألوان وباللغة العربية
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
عنصر البيريليوم Beryllium
أولاً: ما هو عنصر البيريليوم؟ ** البيريليوم Be عنصر من عناصر الجدول الدوري العدد الذري= 4 ، العدد الكتلي= 9 **…
أكمل القراءة » -
الليثيوم Lithium – الخواص الفيزيائية والكيميائية للليثيوم
ما هو عنصر الليثيوم؟ – الليثيوم Li عنصر من عناصر الجدول الدوري، العدد الذري = 3، العدد الكتلي = 7 –…
أكمل القراءة » -
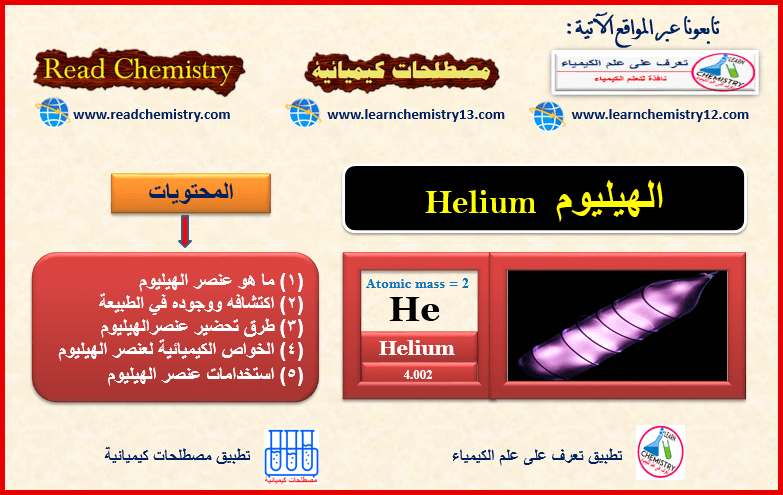
الهيليوم Helium والخواص الفيزيائية والكيميائية للهيليوم
ما هو عنصر الهيليوم؟ – الهيليوم He عنصر من عناصر الجدول الدوري ، العدد الذري= 2 ، العدد الكتلي =…
أكمل القراءة » -
برمنجنات البوتاسيوم – الأكسدة بواسطة برمنجنات البوتاسيوم
– برمنجنات البوتاسيوم من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال وسيتم مناقشة الأكسدة بواسطة برمنجنات البوتاسيوم في هذا الموضوع…
أكمل القراءة » -
تحميل كتاب أطلس الكيمياء للمبتدئين
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع كتاب…
أكمل القراءة » -
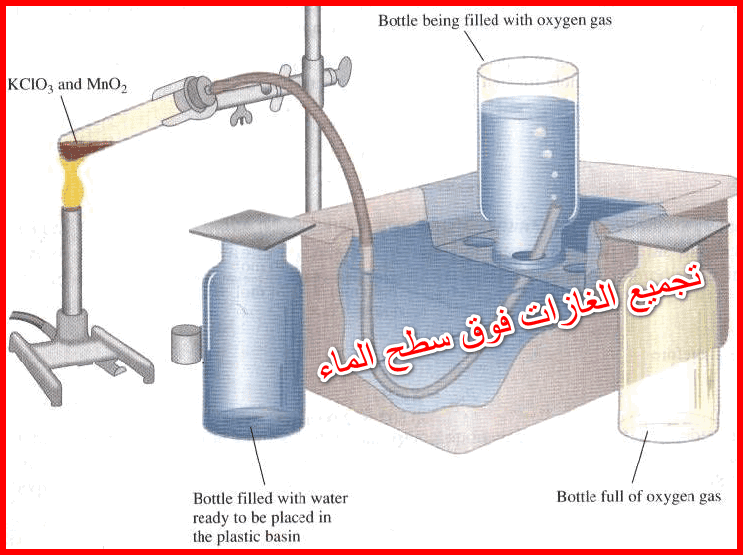
تجميع الغازات فوق سطح الماء
– فى هذا الموضوع سيتم مناقشة كيفية تجميع الغازات فوق سطح الماء Collecting Gases Over Water مع التوضيح عملياً بمثال…
أكمل القراءة » -
الأملاح المتبلرة وماء التبلر Hydrates and Water of Crystallization
تعريف الأملاح المتبلرة Definition of Hydrates يدخل الماء مع أملاح وأيونات معينة مكوناً الملح المائي (Hydrates) ويمكن الحصول على…
أكمل القراءة » -
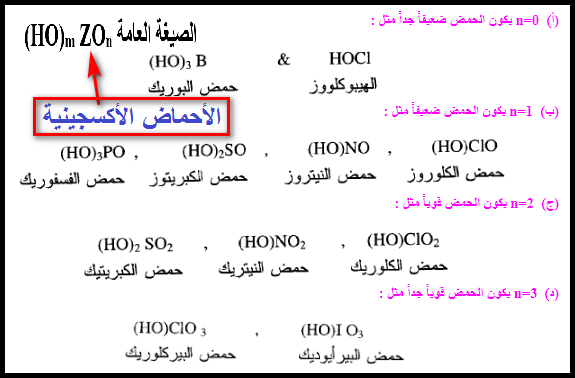
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular structure
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular (Formula) structure لمناقشة علاقة البنية الجزيئية وقوة الحمض…
أكمل القراءة » -
تحضير الأحماض والقواعد والأملاح Preparation of acids, bases and salts
(ِأ)- تحضير الأحماض Preparation of acids نستطيع ان نجمل تحضير الأحماض بأحد الطرق الآتية: 1- الاتحاد المباشر لعنصري الحمض 2-…
أكمل القراءة »