الكيمياء العامة
الكيمياء العامة تُعد أساس فروع الكيمياء، تدرس المادة وخواصها وتغيراتها. تشمل الذرات، الجزيئات، التفاعلات، والمعادلات. تساعد في فهم الظواهر الطبيعية وتطبيقات العلوم في الحياة اليومية.
-
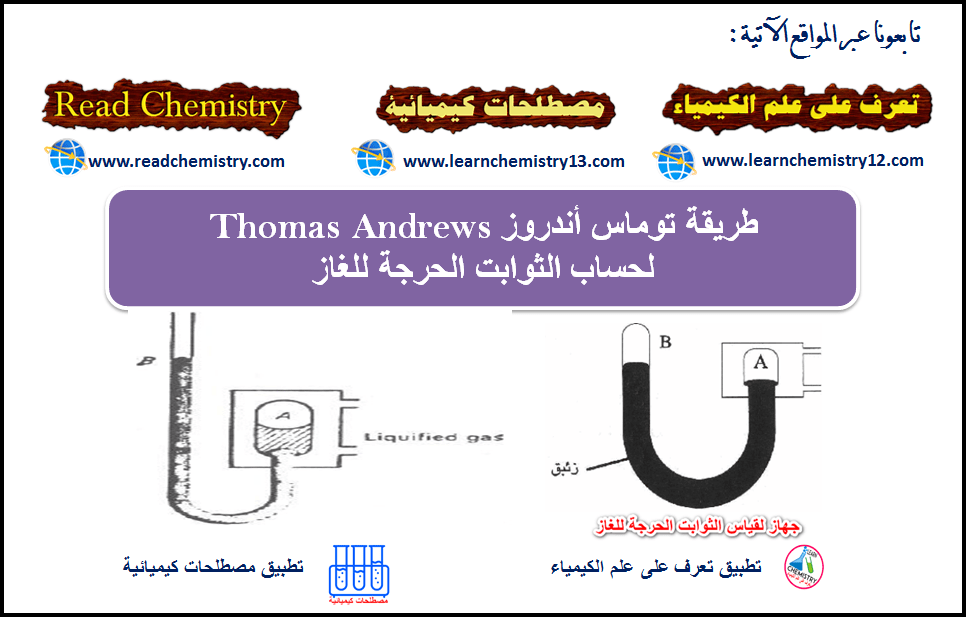
طريقة توماس آندروز(Thomas Andrews) لحساب الثوابت الحرجة للغاز
الثوابت الحرجة Critical Constants – یمكن إسالة غاز ما عند درجات الحرارة المنخفضة بتأثیر الضغط، ومن ثم تقلیل الحجم، وتقریب…
أكمل القراءة » -
إيجاد قيم ثوابت معادلة فاندرفالز Van der waal equation Constants
معادلة الحالة لفان در فالزvan der Waals Equation of State – معادلة فاندرفالز هي معادلة سميت باسم واضعها العالم الهولندي…
أكمل القراءة » -
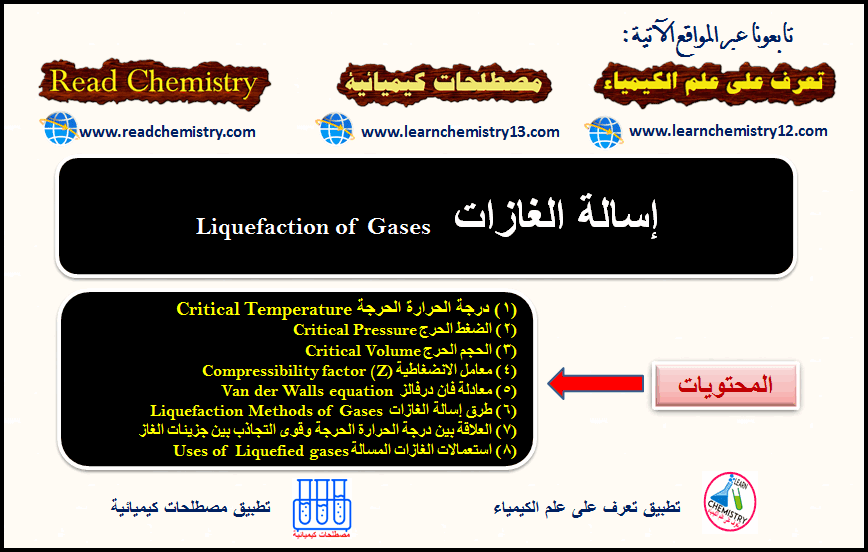
إسالة الغازات Liquefaction of Gases
إسالة الغازات: یمكن إسالة غاز ما عند درجات الحرارة المنخفضة بتأثیر الضغط، ومن ثم تقلیل الحجم، وتقریب بعض الجزیئات الى…
أكمل القراءة » -
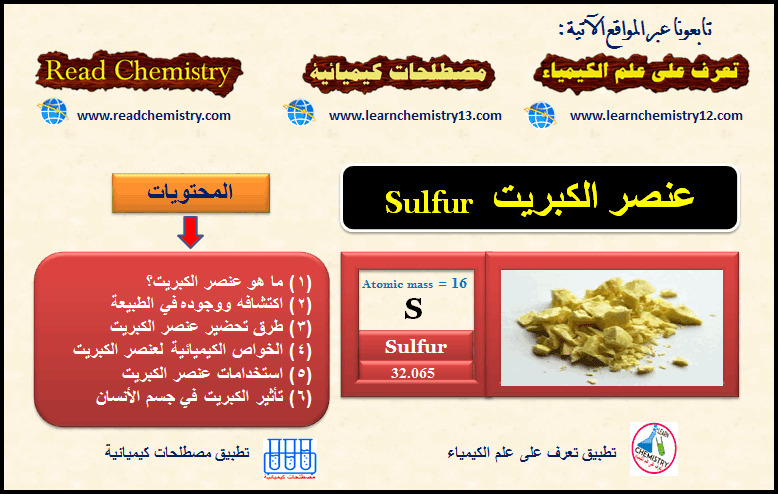
الكبريت Sulfur – الخواص الفيزيائية والكيميائية للكبريت
ما هو عنصر الكبريت؟ What is Sulphur element – هو عنصر من عناصر الجدول الدوري ، العدد الذري له = 16 …
أكمل القراءة » -
معلومات هامة جداً عنصر الفوسفور Phosphorus
أولاً: ما هو عنصر الفوسفور؟ What is Phosphorus element – هوعنصر من عناصر الجدول الدوري ، العدد الذري= 15 العدد…
أكمل القراءة » -
معلومات هامة جداً عن عنصر السيليكون Silicon
أولاً/ ما هو عنصر السيليكون؟ What is Silicon element – هو عنصر من عناصر الجدول الدوري ، العدد الذري له…
أكمل القراءة » -
معلومات هامة جداً عن عنصر الألومنيوم Aluminium
أولاً/ ما هو عنصر الألومنيوم؟ What is Aluminium element – هو عنصر من عناصر الجدول الدوري ، العدد الذري له =…
أكمل القراءة » -
معلومات هامة جداً عن عنصر الماغنسيوم Magnesium
أولاً/ ما هو عنصر الماغنسيوم؟ What is Magnesium element – هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Mg)…
أكمل القراءة » -
معلومات هامة جداً عن عنصر الصوديوم Sodium
أولاً/ ما هو عنصر الصوديوم؟ What is Sodium element – هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Na) ،…
أكمل القراءة » -
معلومات هامة جداً عن عنصر النيون Neon
أولاً/ ما هو عنصر النيون؟ What is Neon element – النيون عنصر من عناصر الجدول الدوري ينتمي إلى مجموعة الغازات…
أكمل القراءة » -
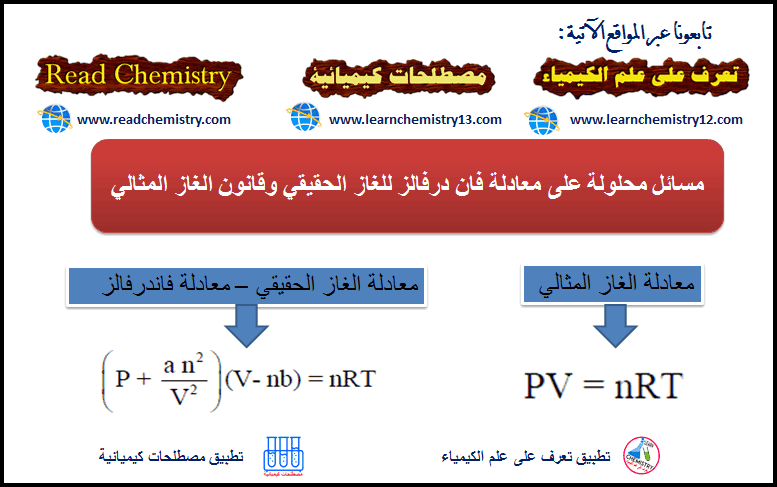
مسائل محلولة على معادلة فان درفالز للغاز الحقيقي وقانون الغاز المثالي
مثال (1) احسب الضغط الذي یؤدیه mol 1.0 من بخار الماء في حجم قدره 20.0 L عند Co 27.0 باستخدام: (أ) قانون…
أكمل القراءة » -
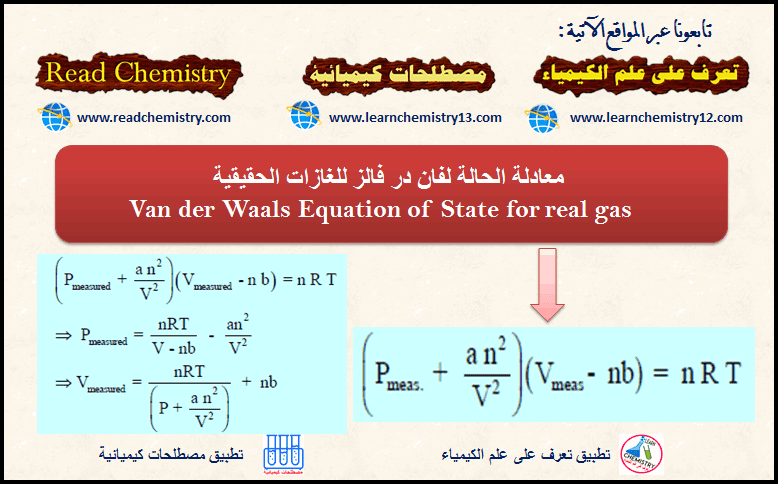
معادلة الحالة فان در فالز لوصف حالة الغاز الحقيقي
معادلة الحالة لفان در فالز van der Waals Equation of State – هي معادلة سميت باسم واضعها العالم الهولندي يوهانس…
أكمل القراءة » -
حيود الغازات الحقيقية عن السلوك المثالي للغازات المثالية
حيود الغازات الحقيقية عن السلوك المثالي – من قانون بويل: P V = Constant ومن القانون العام للغازات فإن:…
أكمل القراءة » -
تحميل كتاب كيمياء اللانثانيدات والأكتنيدات Lanthanides-Actinides
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة » -
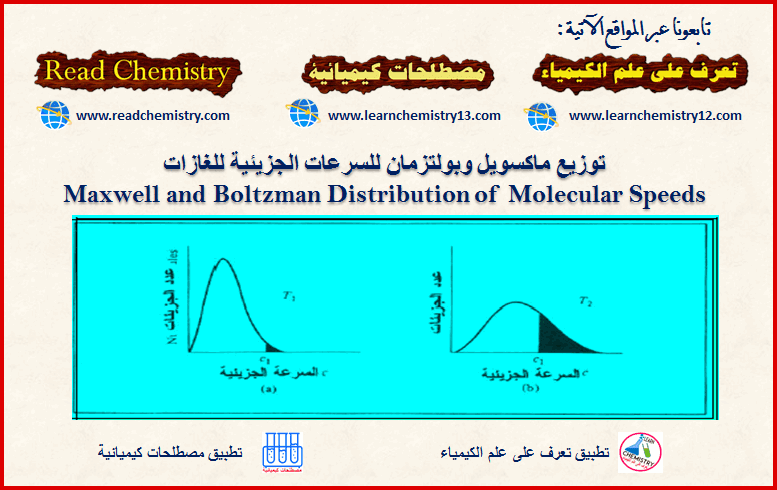
السرعات الجزیئیة للغازات: توزيع ماكسويل- بولتزمان
فى هذا الموضوع سنقوم بشرح السرعات الجزیئیة للغازات – توزيع ماكسويل وبولتزمان Maxwell and Boltzman Distribution مقدمة عن السرعات الجزيئية…
أكمل القراءة » -
السرعة الجزيئية Molecular Speed + مسائل محلولة
السرعة الجزيئية Molecular Speed (النظرية الحركية للغازات) + مسائل محلولة السرعة الجزيئية Molecular Speed – یجدر بنا أن نعتبر خاصیة…
أكمل القراءة » -
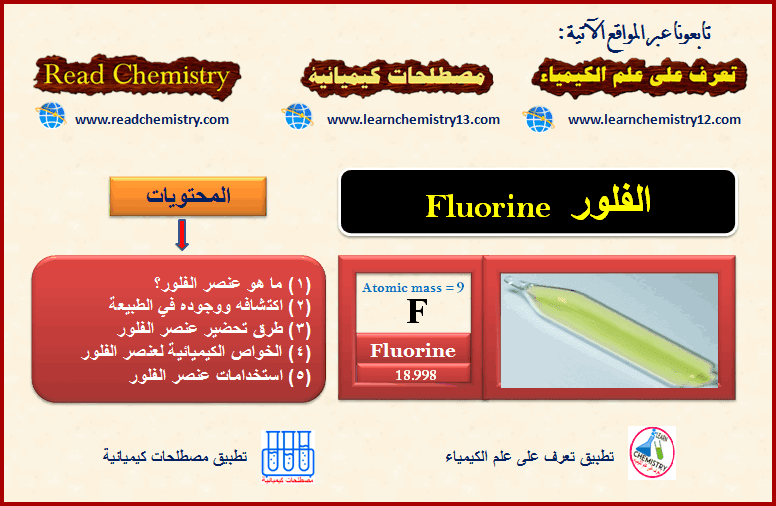
عنصر الفلور Fluorine
أولاً/ ما هو عنصر الفلور؟ What is Fluorine element – الفلور عنصر من عناصر الجدول الدوري ينتمي إلى مجموعة الهالوجينات…
أكمل القراءة » -
العلاقة بين الطاقة الحركية ودرجة الحرارة Relation between KE , T
الطاقة الحركية ودرجة الحرارة Kinetic Energy and Temperature – المعادلة الأساسية للنظرية الحركية للغازات: حيث أن: N: عدد جزيئات…
أكمل القراءة » -
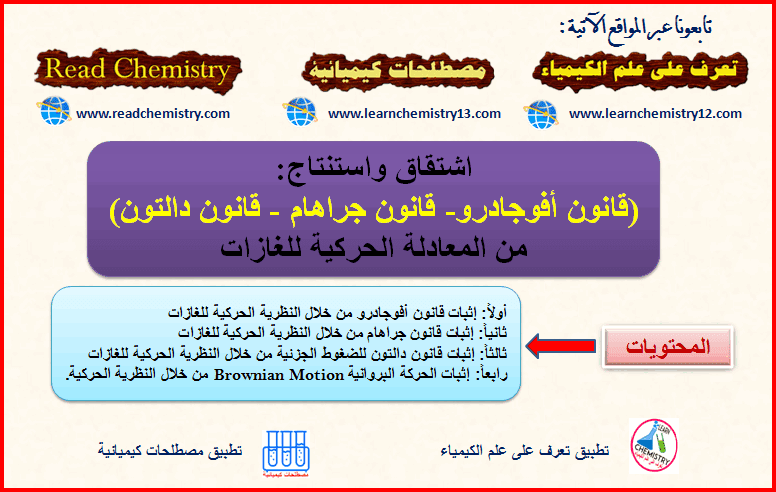
اشتقاق قانون (أفوجادرو – جراهام – دالتون) من المعادلة الحركية للغازات
أولاً/ إثبات قانون أفوجادرو من خلال النظرية الحركية للغازات – أن الأحجام المتساوية للغاز تحت نفس درجة الحرارة والضغط، تحتوي…
أكمل القراءة » -
اشتقاق قانون (بويل – شارل – جاى لوساك) من النظرية الحركية للغازات
يوضح هذا الموضوع كيف استطاعت النظرية الحركية الجزيئية للغازات تفسير قوانين الغازات مثل قانون بويل وقانون شارل وقانون جاى لوساك…
أكمل القراءة »