الفيوران Furan (طرق تحضير الفيوران ومشتقاته – الخواص الفيزيائية)
في هذا الموضوع سيتم مناقشة مركب الفيوران Furan – طرق تحضيره ومشتقاته – الخواص الفيزيائية لهذا المركب وفى الموضوعات القادمة سيتم مناقشة جميع التفاعلات الكيميائية له.
ما هو الفيوران Furan؟
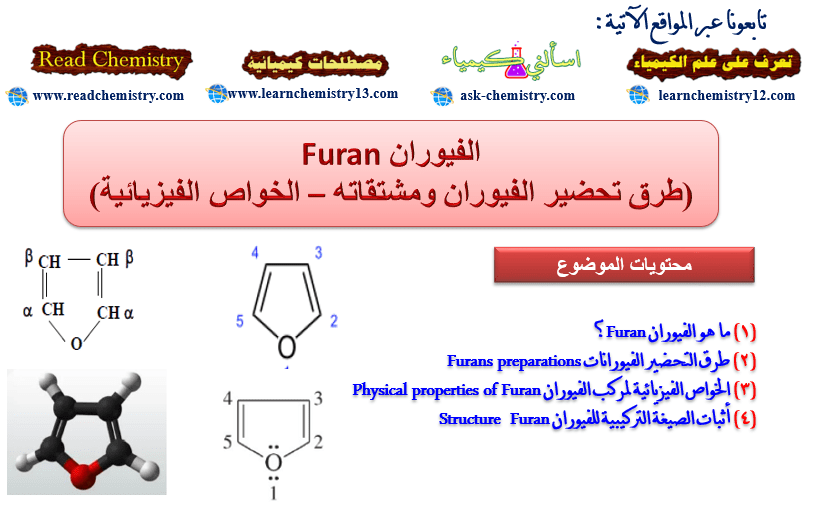
– الفيوران مركب خماسي الحلقة غير متجانس يحتوي على ذرة أكسجين واحدة.
– يحدد مكان السلسة الجانبية أو المجاميع الفعالة على الحلقة بأعداد ويجب أن تأخذ ذرة الأكسجين رقم (1)
– يوجد في قطران خشب الصنوبر.
– وقد اكتشف الفيوران ومشتقاته في حوالي القرن الثامن عشر، عن طريق تقطير حمض الميوسيك، وكذلك بواسطة تأثير حمض الكبريتيك وثاني أكسيد المنجنيز على السكر.
– ويعتبر الفيور فيورال من أكثر مشتقات الفيوران المعروفة وهو ينتج عن طريق التحلل المائي للبنتوزنات الموجودة في نخالة الشعير وقشـور الشوفان حيث يتحول إلى البنتوزات ليعطي الفيورفيورال عند نزع جزيء الماء منه.
– وهو مركب عديم اللون ولكنه يتغير إذا تعرض للهواء الجوي.
– ويعتبر مادة مهمة من الناحية الصناعية.
طرق تحضير الفيوران ومشتقاته Furan preparations
– يمكن الحصول على الفيوران من تقطير الخشب وخصوصا خشب الصنوبر.
– کما أنه يمكن تحضيره بالطرق الآتية:
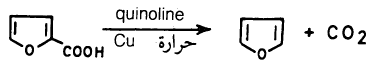
(1) تسخين حمض الفيوريك مع الكينولين في وجود النحاس
حيث تنتزع مجموعة الكربوكسيل ونحصل على الفيوران مع العلم أن حمض الفيوريك يحضر من تقطير حمض الميوسيك.
(2) تسخين الفيورفيورال إلى الحالة البخارية في وجود عامل مساعد
يحضر الفيوران في الصنـاعـة عن طريق تسخين الفيورفيورال إلى الحالة البخارية في وجود عامل مساعد مثل النيكل حيث ينزع أول أكسيد الكربون ويتكون الفيوران.
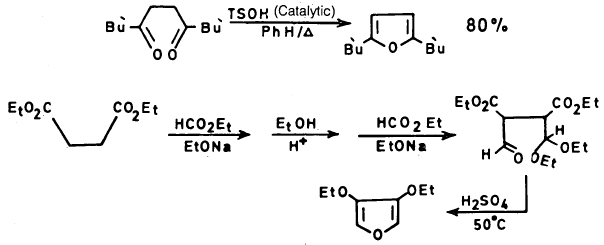
(3) من 4.1- مجموعة الكربونيل مع عامل نازع للماء
يمكن أن يحضر الفيوران من 4.1- مجموعة الكربونيل المناسبة سواء كانت الدهيدية أو كيتونية أو غيرها.
ويستخدم عامل نازع للماء مثل H2SO4 أو P2O5 على أن يكون وسط التفاعل حمضياً ولا يكون مائياً ويمكن أن يتم هذا التفاعل كما يلي:
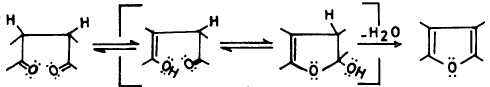
أما ميكانيكية التفاعل الأول فيعتقد أنها تتم كما يلي:
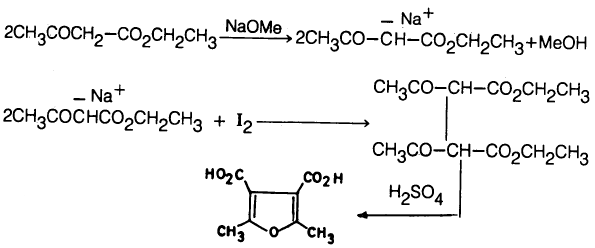
(4) من إثيل أسيتـواسـيتـات ( Ethyl acetoacetate) في وجـود قاعـدة قوية واليود.
كما أنه يمكن تحضير مشتقـات الفيوران من إثيل أسيتـواسـيتـات (Ethyl acetoacetate) في وجـود قاعـدة قوية واليود حيث يتكون ثنائي اسيتواستر حمض السكسنيك (Di aceto succinic ester) والذي يسخن بدوره مع حمض الكبريتيك حيث يعطي مشتق الفيوران.
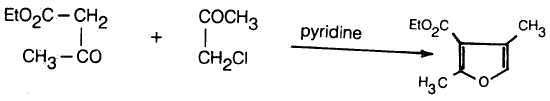
(5) طريقة فيست ـ بيناري Felst – Banary synthesis
في هذه الطريقة يتم التفاعل بين الفا ـ كلوروكيتون مع بيتا ـ كيتواستر في وجود قاعدة مثل البيريدين .
الخواص الفيزيائية لمركب الفيوران Physical properties of Furan
- الفيوران سائل عديم اللون.
- يغـلي عنـد 31-36م.
- تشبه رائحته رائحة الكلوروفورم.
- شحيح الذوبان في الماء ولكنه يمتزج مع أغلب المذيبات العضوية.
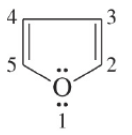
أثبات الصيغة التركيبية للفيوران Furan Structure
– أثبتت حسابات حرارة التكوين وحرارة الهدرجة وكذلك حسابات المدارات الجزئية (Molecular orbital calculation) للفيوران أنه يحتوي على طاقة تأرجح مقدارها (26 ك سعر / جزيء) أي أنها أصغر من تلك التي للبنزين (36 ك سعر/جزيء).
– وقد أثبتت التجارب أن أطوال الروابط في الفيوران تقع بين أطوال الروابط الأحادية والثنائية .
– وحيث إن تهجين ذرات الكربون عبارة عن sp2 وذرة الأكسجين تقدم زوجاً من الإلكترونات فإن ذلك يجعل التركيب الحلقي العطري مكتملاً، ويوافق قاعدة هوكل (4n + 2) وهذا ما يميز هذه المركبات .
– وهذا يعني أن صيغة الفيوران الكلاسيكية (I) لا تمثل الحقيقة بدقة.
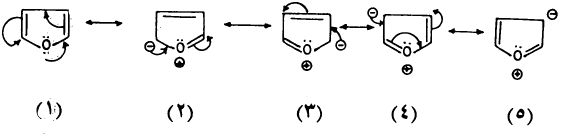
– ولكن يمكن اعتبارها هجيناً تأرجحياً لعدة صيغ تأرجحية (رنين) كما هو مبين:
وهذا يشبه الصيغ التأرجحية للبيرول.
وأهم الصيغ التأرجحية السابقة بعد الصيغة (1) هي الصيغة (2)، (3) وذلك لعدة أسباب منها:
(1) الطاقة اللازمة لفصل الشحنات منخفضة بالمقارنة مع الصيغ الأخرى وذلك بسبب قرب المسافة بين الشحنات.
(2) الروابط والشحنات في الصيغة (2)، (3) في وضع متبادل (Conjugated) ولذلك أكثر ثباتاً من الصيغ الأخرى.
(3) قياسات كثافة إلكترونات باي (π) وكذلك طاقة التوضع للهجوم الإلكتروفيلي والذي يفضل موضعي (2) ، (5) يتبين من الشكل التالي:
وهذا ما يجعل الاستبدال الإلكتروفيلي يفضل موضعي (2)، (3)
ونظراً لأن الأكسجين أكثر كهروسالبية من الكربون فإن مداراته تكون أكثر تمسكاً بالإلكترونات من ذرات الكربون وهذا يجعل التداخل بين مدارات الكربون والأكسجين أقل مما يحد من حرية حركة الإلكترونات وبالتالي يقلل من الصفة العطرية لمركب الفيوران إذا ما قورن بكل من البيرول والثيوفين.
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني


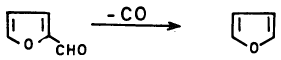
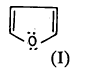






اكتب الرنين الهجينة للفيوران والثيوفين
موجودة داخل الموقع … أكتبى في البحث كلمة (الفيوران) وكلمة (الثيوفين)