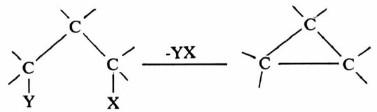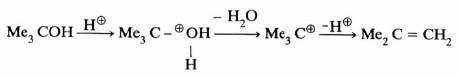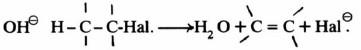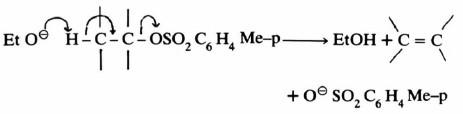ميكانيكية تفاعلات الانتزاع/ الحذف Elimination reactions E1 , E2
تعريف تفاعلات الانتزاع أو تفاعلات الحذف Elimination reactions
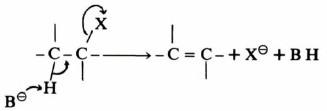
– هي تلك التفاعلات التي يتم فيها انتزاع ذرتين أو مجموعتين أو مجموعة وذرة من جزئ دون استبدالها بذرات أو مجموعات أخرى.
– يطلق على هذا النوع باللغة العربية تفاعلات الانتزاع أو تفاعلات الحذف
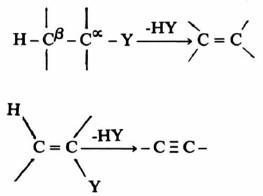
(1) تفـاعـلات انـتـزاع بيتا (B-Elimination)
– وفي أغلب الأحيان فإنه في مثل هذه التفاعلات يتم الانتزاع من ذرتي كربون متجاورتين.
– وفي العادة تكون إحدى الذرات هي البروتون والمجموعة أو الذرة الأخرى عبارة عن عامل نيكليوفيلي.
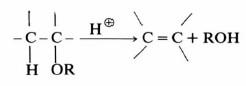
– وينتج عن ذلك تكون رابطة مضاعفة بين ذرتي الكربون كما هو واضح في التفاعلات الآتية:
ويسمى مثـل هـذه التفـاعـلات انـتـزاع بيتا (B-Elimination)
أما في حالة انتزاع بيتا وعندما تكون الذرتان المنتزعتان هما ذرتا هيدروجين فإن ذلك يتبع تفاعلات الأكسدة والاختزال.
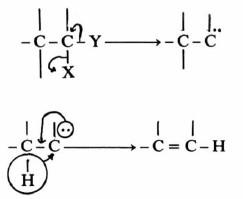
(2) تفـاعـلات انـتـزاع الفـا ( α-Elimination)
– في تفاعلات انتـزاع الفـا ( c-Elimination) فيتم بانتزاع المجاميع من ذرة كربون واحدة.
– وينتج عن ذلك الكربين المعروف بنشـاطـه تجاه تفـاعـلات كثيرة مثل تفاعلات التحول الموضعي حيث إن الهيدروجين الموجود على ذرة الكربون بيتا المجاورة ينتقل إلى ذرة الفا وتتكون رابطة مزدوجة:
– أما في حالة الانتزاع من على ذرة النيتروجين فإنه يؤدي إلى تكون النيترين والذي يتفاعل بصورة مشابهة لتفاعلات الكربين.
(3) تفـاعـلات انـتـزاع جاما ( γ-Elimination)
كما أن هناك نوع آخر من الانتزاع يسمى انتزاع جاما ( γ-Elimination). فهذا يؤدي إلى تكون حلقة ثلاثية كما تبينه المعادلة التالية:
أمثلة على تفاعلات الانتزاع Elimination reactions
وسوف نتعرض في هذا الموضوع لتفاعلات الانتزاع التي تؤدي إلى تكون رابطة ثنائية أو ثلاثية مثل تفاعلات انتزاع بيتا ومن أهم هذه التفاعلات:
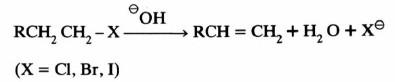
(أ) تفاعلات هاليدات الألكيل مع القواعد.
(ب) عملية انتزاع الماء من الكحولات بوجود الحمض.
(جـ) تفاعلات انتزاع هوفمان (Hofmann elimination) .
وكما هو معروف فإن تفاعلات الاستبدال SN1 , SN2 تكون مصحوبة أحياناً بتفاعلات انتزاع.
ميكانيكية تفاعلات الانتزاع Elimination reactions mechanism
تنقسم ميكانيكية تفاعلات الانتزاع (تفاعلات الحذف) إلى نوعين:
(1) ميكانيكية الانتزاع أحادية الجزيئية Monomolecular Elimination (E1)
(2) ميكانيكية الانتزاع ثنائية الجزيئية (Bimolecular Elimination (E2
وسيتم مناقشة كلاً منهما بالتفصيل
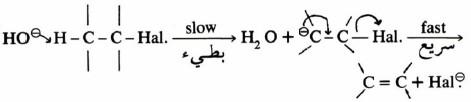
ميكانيكية الانتزاع أحادية الجزيئية Monomolecular Elimination (E1)
– وفي هذا التفـاعـل لا يشترك في الخطوة المحددة لسرعة التفاعل سوى المادة المتفاعلة فقط.
– وتجدر الإشارة إلى أن هناك تشابه بين ميكانيكية الانتزاع E1 و SN1 حيث تعتمد سرعة التفاعل في كل منها على المادة المتفاعلة فقط.
– ويمكن التعبير عن سرعة تفاعل E1 بالمعادلة التالية:
Rate α [Substrate]
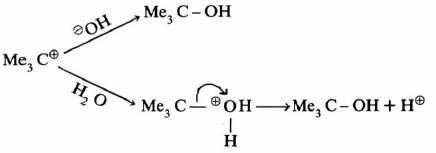
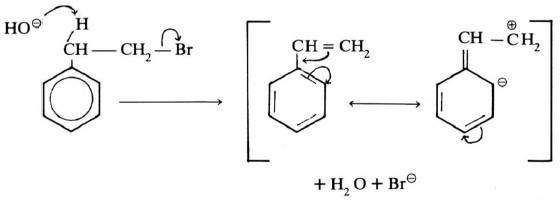
-إذ يتكون في الخطوة البطيئة أيون الكربونيوم وهو يمثل حالة وسطية. ويكون في على شكل زوج أيوني كما هو موضح في المعادلة التالية:
– أما الخطوة التالية فهناك احتمالان: أحدهما تفاعل أيون الكربونيوم مع عوامل نيكليوفيلية مما يؤدي إلى نواتج استبدال SN1 مثل المعادلة التالية:
– أما الحالة الأخرى فتتم عند وجود قواعد تعمل على استخلاص بروتون من ذرة الكربون بيتا في أيون الكربونيوم مما يؤدي إلى تكون رابطة زوجية.
التشابه بين تفاعلات E1 , SN1
– بكل وضوح فإن جميع الشروط التي يجب توافرها في حالة تفاعلات SN1 تؤدي إلى تفاعلات E1 أيضاً، حيث إن أيون الكربونيوم المتكون هو الخطوة الأساسية في كلاً التفاعلين.
– ولقد وجد أن نسبة تكون E1 , SN1 تكون عادة ثابتة عند استخدام نفس مجموعة الألكيل، بغض النظر عن المجموعة التي تنفصل على شكل أيون سالب. وهذا يدل دلالة قاطعة على أن ميكانيكيتي التفاعل E1 , SN1 لها نفس المسار وإلا لكانت نسبة نواتج E1 , SN1 تختلف باختلاف الأيون الخارج.
– ولكن الحال يختلف عند تغيير تركيب مجموعة الألكيل، حيث وجد أن هذا التغيير يؤدي إلى نسب مختلفة في نواتج الانتزاع إلى نواتج الاستبدال.
– وقد وجد أن التفرع على ذرة الكربون بيتا يكون لصالح الانتزاع E1 ، فمثلاً المركب CH3 CH2 C (CH3)2 Cl يعطي 34% أوليفين ( Alkene) بينها المركب CH3)2 CH C (CH3)2 Cl) يعطي ٦٢٪ أوليفين.
– وهذا يوضح أن المركبات الأكثر تشعبـاً تفضـل تـفـاعـلات E1 على SN1 والسبب في ذلك أن عامل التزاحم (Steric effect) له أكبر الأثر على مسار التفاعل حيث إن المركب الأكثر تشعباً يفضل تكون أيون الكربونيوم والذي يحدث له عملية انتزاع أسرع من عملية الاستبدال وذلك لأن المجاميع الكثيرة تعوق تقدم العامل النيكليوفيلي.
– وقد أدت دراسة مركبات مختلفة الهالوجين إلى الاعتقاد بأن التفسير السابق ليس وحده هو المسيطر على هذه التفاعلات حيث وجد أن عملية الدعم الإلكتروني ( Hyperconjugation) تلعب دوراً هاماً حيث تفضل تكون نظير أوليفيني على نظير آخر من نفس أيون الكربونيوم عندما يكون هناك أكثر من ذرة كربون بيتا لها القدرة على فقد البروتون.
الأمثلة المشهورة على ميكانيكية E1
من الأمثلة المشهورة على ميكانيكية E1
(أ) انتزاع الماء من الكحولات
(ب) انتزاع الكحولات من الإيثرات
ميكانيكية تفاعلات الانتزاع ثنائية الجزيئية Bimolecular Elimination E2
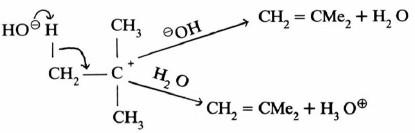
– وفي هذا التفـاعـل تشترك مادتان في الخطوة المحددة لسرعة التفاعل هما المادة المتفاعلة والقاعدة أو الحمض.
– وتتميز ميكانيكية تفاعلات الانتزاع ثنائية الجزئية E2 بخروج المجموعتين المغادرتين في آن واحد.
– ويتضح من المعادلة السابقة أن تفاعل الانتزاع من نوع E2 يتم في خطوة واحدة. على العكس من تفاعل E1 الذي يتم في خطوتين.
– ويمكن التعبير عن سرعة تفاعل E2 بالمعادلة التالية:
التشابه بين تفاعلات E2 , SN2
– التفاعل السابق يدل على أن تفاعلات الانتزاع ثنائية الجزيئية E2 شبيهة تماماً بتفاعلات الاستبدال من الدرجة الثانية SN2 كما أنها منافسة لها.
– وتجدر الإشارة إلى أن الفرق بين مسار التفاعلين E2 , SN2 يكمن في هجـوم الكاشف. فإن هاجم ذرة الكربون المركزية كان الناتج تفاعل استبدال. أما إذا هاجم ذرة الهيدروجين فإن ذلك يقود إلى تفاعل الانتزاع E2
– ولقـد وجـد أنه في معظم الحالات أن تفاعلات E2 تشبه تفاعلات SN2 في التحديد الفراغي (Stereospecific) حيث تكـون الـذرات الخمس المشمـولـة (ومن ضمنها الكـاشف) في مستوى واحد وتكون ذرة X, H في وضع متعاكس Trans وتسمى هذه الحالة (Anti-periplanar) .
– وتكون تفاعلات E2 مشابهة لتفاعلات SN2 من حيث أن المجموعة المغادرة إما متعادلة أو موجبة الشحنة. وتكون القاعدة إما متعادلة أو سالبة الشحنة. ويسهل الحصول على الوضع السابق في المركبات المفتوحة وذلك لإمكانية الدوران حول الرابطة (C – C).
إن الدليل على أن رابطة C-H- قد انشطرت في الخطوة البطيئة المحددة لسرعة التفاعل يمكن الحصول عليه من تأثير النظائر وذلك عند استبدال ذرة الهيدروجين بذرة ديتيريوم في وضـع بيتا.
وإن الميكانيكية الأساسية لتفاعلات E2 هي الخروج الآني لكل من البروتون والهالوجين إلا أن هناك فرضية تبين إمكانية حدوث تفاعلات E2 بخطوتين أولاهما بطيئة والثانية سريعة:
العوامل المؤثرة على سرعة تفاعلات الانتزاع E2
(1) قوة القاعدة
– تتأثر سرعة تفاعلات E2 تأثراً ملحوظاً بقوة القاعدة فقد وجد أن ذلك يتبع الترتيب التالي:
(2) المجموعة المغادرة
– تلعب المجموعة المغادرة دوراً رئيسياً في سرعة تفاعلات E2 فقد وجد أن أنيون الحمض القـوي تكون مغادرته أسهل.
– ومثال على ذلك فقد وجد أن مجموعة Tosylates تغادر بسهـولـة لتعطي ناتجاً أوليفينياً إلا أنها قاعدة مرافقة لحمض قوي.
– ومن العوامل المؤثرة أيضاً على سرعة تفاعلات E2 قوة الرابطة بين المجموعة المغادرة وذرة الكـربـون الفا.
(3) تركيب المادة المتفاعلة
– الجدير بالذكر أن تركيب المادة المتفاعلة يلعب الدور الرئيسي في تفاعلات E2
– كما يساعد في ذلك وجود مجموعة الفينيل على ذرة الكربون بيتا، حيث تعمل على استقرار الأوليفين عن طريق الطنين كما هو واضح من المثال التالي:
المراجع: كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م