الزرنيخ Arsenic – الخواص الفيزيائية والكيميائية للزرنيخ
محتويات الموضوع
ما هو عنصر الزرنيخ Arsenic؟
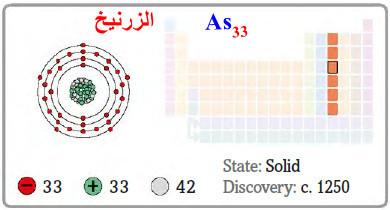
– الزرنيخ هو عنصر من عناصر الجدول الدوري: العدد الذري = 33 ، العدد الكتلي = 75
– الرمز الكيميائي لعنصر الزرنيـخ يرمز له بالرمز: 75As33
– التوزيع الإلكتروني له: Ar]18 4s2 3d10 4p3]
– كما يعتبر الزرنيخ معدن، وهو جسم بلوري رمادي اللون، هش ليّن وله بريق معدني.
– وهو ناقل للكهرباء.
– وله عدة اشكال منها الرمادي، والبني وهو جسم صلب، وأسود وهو جسم شفاف لا بلوري.
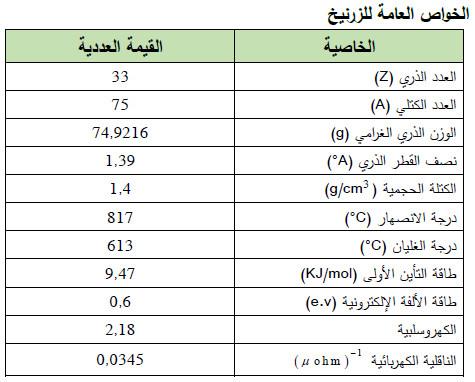
– الجدول التالي يوضح الخواص العامة لعنصر الزرنيـخ كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Arsenic
– اكتشف الزرنيخ عام 1649م من قبل شرودر اشتق اسمه من اللاتينية (Arsenicum).
– للزرنيخ عدة أشكال متأصلة كالفسفور، وهو مادة بلورية هشة، رمادية اللون ذات بريق معدني كالفلاذ، بما أنّ للزرنيـخ المعدني بنية تماثرية عالية، لذا فأنه ينصهر أو يتبخّر فقط عند تغيير بنيته.
– يتسامى عند الدرجة 610 مo تحت الضغط العادي مشكلاً أبخرة ذات لون أصفر ليموني مؤلفة من جزيئات As4
– يتشكل بالتكثيف السريع لأبخرة الزرنيـخ بلورات لينة ذات لون أصفر مؤلفة من الجزيئات As4 بصورة مشابهة للفسفور الأبيض P4 وبالتسخين البطيء يتحول بسرعة إلى الزرنيـخ المعدني.
– من أهم خامات هذا العنصر:
أوربيمنت Orpiment أو الوهج الأصفر ورمزه الكيميائي As2S3 وكان يستخدم قديماً فى صناعة الدهانات.
رهج الغار أو الزرنيخ الأحمر Realgar هو يتكون من معدن كبريتيد الزرنيـخ (α-As4S4)
طرق تحضير الزرنيخ Preparation of Arsenic
– يحضر الزرنيخ باختزال أكسيد الزرنيـخ بواسطة الكربون:
2As2O3 + 3C → As4 + 3CO2
كما يمكن الحصول عليه بتقطير بعض الكبريتيدات المحتوية على الزرنيـخ
FeSAs → FeS + As
الخواص الكيميائية للزرنيخ Chemical properties of Arsenic
(1) التفاعل مع الأكسجين
– لا يتأكسد الزرنيخ بسهولة في الهواء عند درجات الحرارة العادية، ولكنه يشتعل عند تسخينه في الهواء مكوناً As4O6 كما بالمعادلة الآتية:
4As + 3O2 → As4O6
(2) التفاعل مع الهيدروجين
– يتفاعل الزرنيخ مباشرة مع الهيدروجين معطيا الأرسين AsH3 كما بالمعادلة الآتية:
2As + 3H2 → 2AsH3
(3) التفاعل مع الهالوجينات
– يتفاعل الزرنيـخ مع غاز الكلور معطياً ثالث كلوريد الزرنيـخ كما بالمعادلة الآتية:
2As + 3Cl2 → 2AsCl3
(4) التفاعل مع الكبريت
– يتفاعل الزرنيخ مع الكبريت بتسخين مكوناُ ثالث كبريتيد الزرنيـخ كما بالمعادلة الآتية:
4As + 3S → As2S3
(5) التفاعل مع القواعد
– يتفاعل الزرنيخ مع الأسس مشكلاُ شاردة الزرنيخيت –AsO33 كما بالمعادلة الآتية:
2As + 6OH– → 2AsO33- + 3H2
استخدامات الزرنيخ Uses of Arsenic
(1) لقد عرف الزرنيـخ منذ قديم الزمان بسمّيته، كان يجري استخدامه في قرون ماضية في معالجة مرض الزهري.
(2) كما يستخدم بشكل أساسي في تحضير بعض المبيدات وسم الفئران.
(3) ويستعمل أحيانا في صناعة الخزف وفي حفظ الأخشاب.
(4) يدخل في تصنيع الأقطاب في بطاريات السيارة.
(5) كما يستخدم في صناعة الطلقات النارية كما بالشكل التالى
(4) مادة مرسخة في عمليات الصباغة.
(5) يستخدم كذلك في مواد الزراعة مثل: المضادات الحيوية والإضافات الغذائية.
تأثير الزرنيخ على جسم الإنسان
– عند ابتلاع مركبات الزرنيخ سرعان ما يتم امتصاصها بنسبة 90 – 80 % عبر القناة المعدية المعوية ليجري توزيعها في الدم وصولاُ إلى الكبد والكلية والرئة والطحال والشريان الأبهر والجلد.
– يتم اختزال الزرنيخ الخماسي التكافؤ إلى الزرنيـخ الثلاثي التكافؤ في الجسم. وبعدئذ تجري مثيلة هذا الأخير في الكبد لينشأ الحمض الأقل سمية والذي يدعى حمض الزرنيـخ الميثيلي والذي يسهل طرحه.
– ويتم التخلص من أغلب الزرنيـخ خلال أسبوع بنسبة %0.9 ولاسيما من الكبد والكلية والطحال في حين يبقى ما يوجد منه في الجلد والدماغ والهيكل العظمي لمدة زمنية أطول.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.











رائع