الساماريوم Samarium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الساماريوم Samarium؟
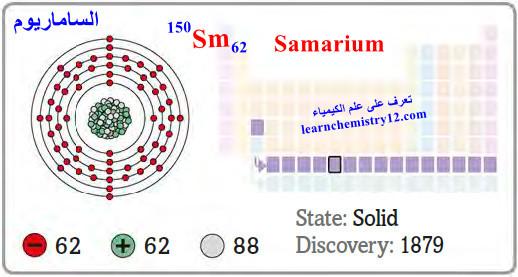
– الساماريوم Samarium هو عنصر من عناصر الجدول الدوري: العدد الذري = 62 ، العدد الكتلي = 150
– الرمز الكيميائي لعنصر الساماريوم يرمز له بالرمز: 150Sm62
– التوزيع الإلكتروني له: Xe]54 6s2 4f6]
– الساماريوم أحد عناصر اللانثانيدات وهو فلز أرضي نادر فضي اللون، مستقر في الهواء الجاف.
– باالإضافة إلى ذلك فأنه يشكل طبقة أكسيدية فوق الأسطح المعرضة للهواء الرطب.
– يحترق بسهولة كما أنه شديد التفاعل مع الماء.
اكتشافه ووجوده في الطبيعة Discovery of Samarium
– اكتشفت لوكوك دوبوا بوردان (فرنسا) هذا العنصر سنة 1879م في عينة من معدن اسمه سامارسكيت Samarskite.
– وقد سمي بهذا الاسم لأن العالم الروسي سامارسكي كان قد درسه لذلك سمي العنصر ساماريوم.
– يتواجد في القشرة الأرضية وتبلغ نسبته حوالي 6.5 جرامات في الطن.
– مع ذلك، هناك معدن آخر غني باللانثانيدات يسمى المونازيت Monazite هو المصدر الرئيسي لهذا العنصر اليوم.
مركبات الساماريوم Samarium Compound
(1) أكسيد الساماريوم الثلاثي Sm2O3
– هو مركب كيميائي يكون على شكل بلورات بيضاء إلى صفراء.
– أكسيد الساماريوم الثلاثي لا ينحل في الماء، لكنه ينحل في الأحماض المعدنية مشكلاً الأملاح الموافقة، فهو يتفاعل مع حمض هيدروكلوريك مشكلاً كلوريد السماريوم الثلاثي كما بالتفاعل التالي:
Sm2O3 + 6HCl → 2SmCl3 + 3H2O
– يمكن لأكسيد الساماريـوم أن يحضر بإحدى طريقتين:
(أ) إما بالتفكك الحراري لمركبات الساماريـوم الحاوية للأكسجين مثل الكربونات أو الأكسالات أو الكبريتات كما بالتفاعل التالي:
Sm2(CO3)3 → Sm2O3 + 3CO2
(ب) أو بحرق فلز الساماريوم بأكسجين الهواء عند درجات حرارة تفوق 150°C كما بالتفاعل التالي:
4Sm + 2O2 → 2Sm2O3
– يستخدم أكسيد الساماريـوم الثلاثي في تصنيع الأجهزة البصرية في المطيافيات، وخاصة في تصنيع الزجاج الذي يمتص الأشعة تحت الحمراء.
– يستخدم كمادة ماصة أو ساحبة للنيوترونات في قضبان التحكم في منشآت الطاقة النووية.
– كما يستخدم كمحفز لعملية بلمهة الكحولات الأولية غير الحلقية إلى ألدهيدات وكيتونات.
– يستخدم من أجل تحضير مركبات الساماريـوم الأخرى.
(2) كلوريد الساماريوم الثلاثي SmCl3
– كلوريد الساماريوم الثلاثي مركب كيميائي له الصيغة SmCl3
– يكون على شكل بلورات صفراء شاحبة في الشكل اللامائي، أما على شكل سداسي هيدرات SmCl3.6H2O فله لون كريم.
– لمركب كلوريد الـساماريـوم الثلاثي انحلالية جيدة في الماء، وله شغف كبير للرطوبة حيث تظهر خاصية الاسترطاب بشكل واضح بأنه يشكل سداسي الهيدرات.
– ينحل المركب أيضاً في الإيثانول.
– كما يعد كلوريد السماريـوم الثلاثي من أحماض لويس القوية.
– يتفاعل بسهولة مع مركبات مثل هيدروكسيد الصوديوم وفلوريد البوتاسيوم، لتشكيل أملاح الساماريـوم غير المنحلة كما بالتفاعلات التالية:
SmCl3 + 3NaOH → Sm(OH)3 + 3NaCl
SmCl3 + 3KF → SmF3 + 3KCl
– يحضر كلوريد الساماريوم الثلاثي من تفاعل فلز الساماريوم مع حمض هيدروكلوريك، ويمكن أن يجرى التفاعل باستخدام كربونات الساماريـوم الثلاثي كما بالتفاعلات التالية:
2Sm + 6HCl → 2SmCl3 + 3H2
Sm2(CO3)3 + 6 HCl → 2SmC13 + 3CO2 + 3H2O
ويتم نزع الماء من كلوريد الساماريوم الثلاثي بمفاعلته مع غاز كلوريد الهيدروجين.
– كما يمكن الحصول عليه من إجراء عملية تجفيف لسداسي الهيدرات، وذلك بالتسخين إلى °400C بوجود من 4 إلى 6 مكافئ من كلوريد الأمونيوم تحت الفراغ أو بالتسخين مع كمية فائضة من كلوريد الثيونيل لمدة خمس ساعات.
– يستخدم كلوريد الساماريوم الثلاثي من أجل الحصول على فلز الساماريوم، حيث يمزج المركب مع كل من كلوريد الصوديوم وكلوريد الكالسيوم من أجل تخفيض نقطة الانصهار. بعد صهر المركب تجرى له عملية تحليل كهربائي فنحصل على الفلز الحر.
– يستعمل من أجل تحضير أملاح الساماريوم الأخرى ومركبات الساماريوم العضوية الفلزية مثل المعقدات التي تستخدم من أجل تحفيز تفاعلات الهدرجة والسيللة المهدرجة Hydrosilylation للألكينات.
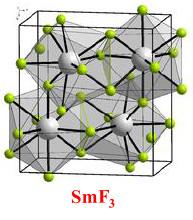
(3) فلوريد الساماريوم الثلاثي SmF3
– فلوريد الساماريوم الثلاثي مركب كيميائي يكون على شكل مسحوق بلوري أصفر.
– لا ينحل مركب فلوريد الساماريوم الثلاثي في الماء.
– لبلورات فلوريد الساماريـوم الثلاثي بنية بلورية تتبع النظام المعيني المستقيم، وبتسخينها تحت درجة حرارة 495Co يحدث هنالك تغير في البنية البلورية، وتتحول البلورات من النظام المعيني المستقيم إلى النظام الثلاثي المشابه لفلوريد اللانثانيوم الثلاثي LaF3
(4) ثنائي كبريتيد الساماريوم SmS2
– يتم الحصول عليه بخلط مزيج من مسحوق فلز الساماريوم مع مسحوق الكبريت في آنية من زجاج الكوارتز مفرغة من الهواء مع التسخين حتى 1000 كلفن.
– وبعد الحصول على الناتج يفتت بحذر ويودع ضمن أنبوب مغلق من التنتاليوم ويسخن حتى درجة حرارة 2300Co
(5) ثلاثي كبريتيد الساماريوم Sm2S3
– كبريتيد الساماريوم الثلاثي مركب كيميائي يكون على شكل بلورات حمراء بنية.
– يوجد نمطان للبنية البلورية لمركب كبريتيد الساماريـوم الثلاثي النمط ألفا Sm2S3 – α وهو يتبع النظام البلوري المعيني المستقيم، أما النمط غاما γ – Sm2S3 فله بنية مكعبة.
– يمكن المركب كبريتيد الساماريوم الثلاثي أن يحضر عن طريق معالجة ثيوسيانات الأريلات مع 2.3 مكافئ من يوديد الساماريوم الثنائي حيث يتشكل الناتج كمركب وسيط، يمكن عزله عن طريق عدة كواشف محبة للإلكترونات.
الخواص الكيميائية لعنصر الساماريوم Chemical properties of Samarium
(1) التفاعل مع الهواء
– الساماريوم المعدني يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثلاثي أكسيد ثنائي الساماريوم كما بالتفاعل التالي:
4Sm + 3O2 → 2Sm2O3
(2) التفاعل مع الماء
– الساماريوم المعدني يتميز بكهروإيجابية عالية فيتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد الساماريوم وغاز الهيدروجين كما بالتفاعل التالي:
2Sm + 6H2O → 2Sm(OH)3 + 3H2
(3) التفاعل مع الهالوجينات
– الساماريوم المعدني يتفاعل مع كل الهالوجينات ليشكل هاليدات الساماريوم الثلاثية.
– لذلك يتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي: ثلاثي فلوريد الساماريـوم، ثلاثي كلوريد الساماريـوم، ثلاثي بروميد الساماريـوم، ثلاثي يوديد الساماريـوم، كما بالتفاعلات التالية:
أبيض 2Sm(s) + 3F2(g) → 2SmF3(s)
أصفر 2Sm(s) + 3Cl2(g) → 2SmCl3(s)
أما فى حالتى البروم واليود يكون كما يلي:
أصفر 2Sm(s) + 3Br2(g) → 2SmBr3(s)
برتقالي 2Sm(s) + 3I2(g) → 2SmI3(s)
(4) التفاعل مع الأحماض
– معدن الساماريوم يذوب بسهولة في حمض الكبريتيك المخفف لتشكيل محاليل تحتوي على اللون الأصفر كما بالتفاعل التالي:
2Sm + 3H2SO4 → Sm2(SO4)3 + 3H2
استخدامات الساماريوم Uses of Samarium
(1) يستخدم لامتصاص النيترونات في المفاعلات النووية.
(2) كما يستخدم الساماريوم في صناعات السيراميك والالكترونيات.
(3) الساماريوم سهل التمغنط ومن الصعب جداً إزالة المغناطيسية وهذا يقترح تطبيقات مستقبلية مهمة في تقنيات الحالة الصلبة والموصلية العالية.
(4) علاوة على ذلك يستخدم الساماريـوم لتحديد عمر الصخور والنيازك.
(5) يتم خلط الساماريوم مع الكوبالت لصنع مغناطيس دائم يستخدم غالبًا في القيثارات الكهربائية (الجيتار الكهربي).
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017