السيزيوم Caesium – الخواص الفيزيائية والكيميائية للسيزيوم
محتويات الموضوع
ما هو عنصر السيزيوم Caesium؟
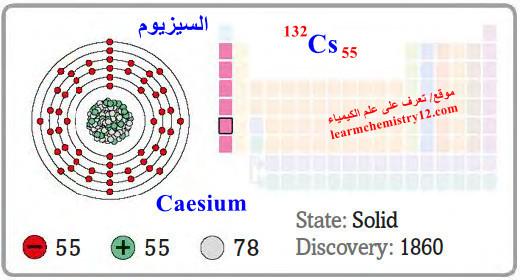
– السيزيوم Caesium هو عنصر من عناصر الجدول الدوري: العدد الذري = 55 ، العدد الكتلي = 132
– الرمز الكيميائي لعنصر السيزيوم يرمز له بالرمز: 132Cs55
– التوزيع الإلكتروني له: Xe]54 6s1]
– السيزيوم فلز أبيض ناعم فضي اللون لين كالشمع وخفيف كالمغنسيوم.
– يتحول بسهولة إلى الحالة السائلة لأن درجة انصهاره صغيرة، وتكفي حرارة اليد أن تذيبه.
– نرجو من القارئ ألا يحاول ذلك، لأن السيزيـوم ذو طبع شرس وقد يسبب عواقب وخيمة.
– ونظرا لطبيعته المميزة فهو يحفظ بخلطه مع فلزات أخرى، وسبائكه لیست مشاغبة مثله، ويمكن حفظها بسلام لفترة طويلة ويتم فصله منها بالتقطير تحت الفراغ.
– باعتباره أكثر المعادن تفاعلًا على وجه الأرض، ينفجر السيزيوم في ألسنة اللهب إذا لامس الهواء أو الماء، لذلك يتم تخزين السيزيـوم النقي في أنبوب زجاجي مغلق يتم امتصاص كل الهواء منه.
– وإذا اجتمع مع الكبريت أو الفوسفور فإنه يتمرد ويثور بالغاً حد الانفجار
– كما أن معاشرة السيزيـوم للماء لا تخلو من الخلافات الحادة والعنيفة التي تؤدي إلى انفجارات وحرائق.
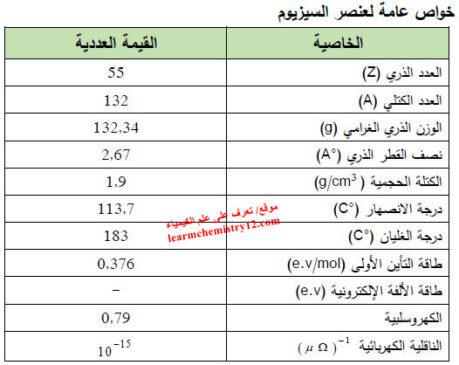
– الجدول التالي يوضح الخواص العامة لعنصر السيزيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Caesium
– تم اكتشاف السيزيوم في عام 1860م من قبل العلماء الألمان روبرت بنسن وجوستاف كيرشوف.
– لقد أحرقوا عينة من المياه المعدنية على الموقد، مما أدى إلى تقسيم ضوء اللهب إلى ألوان فردية. كان أحدهم أزرق فاتح مميز، جاء من السيزيوم.
– اشتق اسمه من الكلمة اللاتينية Caesium بمعنى الأزرق الرمادي أو (السماء الزرقاء) ويشير إلى لون لهب السيـزيوم عند الاحتراق.
– هذا العنصر نادر، ويتم استخلاص معظمه من خام البولوسيت المعدني Pollucite الذي يستخدم في صنع المجوهرات.
– يتم الحصول على الجزء الأكبر منه من كلوريد السيزيـوم بعملية كيميائية، يتأين السيزيوم عندما يسخن أو يعرض للضوء. تتوزع أملاح السيزيـوم المذابة مثل كربونات السيزيـوم وكلوريد السيزيـوم على نطاق واسع وبتركيز منخفض في المحاليل والمياه المعدنية.
– كما يوجد أيضاً في الشمندر السكري وحبوب القهوة وأوراق الشاي.
تحضير السيزيوم Preparation of Caesium
– يحضر من التفكك الحراري للمركب CsN3 في 500مo، أو التفكك الحراري لهيدريد السيزيـوم CsH في 300مo.
مركبات السيزيوم Caesium Compound
(1) هيدروكسيد السيزيوم CsOH
– للسيزيوم هيدروكسيد صيغته CsOH يكون على شكل بلورات بيضاء تميل إلى الصفرة.
– ينحل بشكل جيد في الماء كما ينحل في الإيثانول.
– كما تمتاز محاليله بصفة قاعدية قوية.
– هو مركب شره جداً للاستقطاب بحيث يوجد غالباً في المختبرات الكيميائية على شكل أحادي هيدرات.
(2) فلوريد السيزيوم CsF
– مركب كيميائي صيغته CsF يكون على شكل بلورات بيضاء اللون.
– مركب سام، لذا يجب التعامل معه بحيطة وحذر.
– نظراً لوجود فرق كبير في الكهروسالبية بين الفلور والسيزيوم فإن مركب فلوريد السيزيـوم يعد من أكثر المركبات الكيميائية التي تتميز الصفة الأيونية فيها.
– وكما في الفلوريدات الأخرى فهو يتميز بصفة قاعدية ضعيفة وذلك لضعف HF
– يحضر أثر حمض الهيدروفلوريك على هيدروكسيد أو كربونات السيـزيوم، تتبعها عملية تجفيف يحضر من للتخلص من الماء.
– يتميز فلوريد السيـزيوم بتفاعلاته التي تمنح الفلوريد بشكل سهل، مثل تفاعله مع كلوريد الكالسيوم كما بالتفاعل التالي:
2CsF(aq) + CaCl2(aq) → 2CsCl(aq) + CaF2(s)
– يستخدم فلوريد السيـزيوم في إزالة السيليكون من المركبات العضوية، وذلك نظراً لقوة الرابطة (F-Si) فيستعمل مع رباعي هيدروفوران THF وثنائي ميثيل فورماميد DMF ليهاجم مركبات السيليكون العضوية.
(3) يوديد السيزيوم CsI
– مركب كيميائي صيغته CsI، يكون على شكل بلورات عديمة اللون.
– تسيل عند تماسها مع الهواء.
– له انحلالية جيدة في الماء (حوالي 40 جم لكل 100 مل من الماء) وينحل في الإيثانول.
– يحضر يوديد السيـزيوم من تفاعل يوديد الهيدروجين مع هيدروكسيد السيزيـوم كما بالتفاعل التالي:
CsOH + HI→ CsI + H2O
(4) كربونات السيزيوم CS2CO3
– مركب كيميائي صيغته CS2CO3، يكون على شكل بلورات بيضاء اللون.
– كما ينحل بشكل كبير جيد في الماء، كما أن بلوراته تتسيل عند تماسها مع الهواء الرطب.
– تكون للمحاليل المائية مع كربونات السيزيوم صفة قاعدية وذلك بشكل مشابه لكربونات الفلزات القاعدية.
– كما تنحل كربونات السيـزيوم في المذيبات العضوية مثل ثنائي إيثيل الإيثير والإيثانول.
– يحضر من مزيج معدني، بولوسيت ( (Pollocit) وسبودومين ( (Spodomene) اللذان يسخنان بوجود هيدروكسيد الكالسيوم إلى درجة حرارة 220مo ، ثم بإجراء عملية ترشيح من سيليكات الكالسيوم غير المنحلة، ثم يجرى ترسيب للأملاح الأخرى الموجودة على شكل محلول قاعدي.
– تجرى عملية تعديل للمحلول باستخدام حمض الكبريتيك ، فنحصل على شـب الأمونيوم والسيزيوم، وبإجراء عملية اعادة بلورة نحصل على شكل أنقى من الشب بعد ذلك نحصل على كربونات السيـزيوم بشكل نقي بتمرير غاز ثاني أكسيد الكربون على محلول الشب النقي.
(5) مركبات أخرى
– الجدول التالي يوضح أهم المركبات المشهورة للسيزيوم كما يلي:
الخواص الكيميائية لعنصر السيزيوم Chemical properties of Caesium
(1) التفاعل مع الهواء
– السيزيوم لين جداً وينكسر بسهولة.
– يتميز بسطح لامع وبراق إلا أنه يتشوه بسهولة بسبب الرطوبة وأكسجين الهواء فيتشكل ثاني أكسيد السيزيـوم كما بالتفاعل التالي:
CS(s) + O2(g) → CSO2(s)
(2) التفاعل مع الماء
– السيزيوم يتفاعل مع الماء بشكل عنيف وسريع بحيث إذا تم التفاعل في وعاء زجاجي فإن هذا الوعاء سيتحطم، ويرافقه تحرير غاز الهيدروجين كما بالتفاعل التالي:
2Cs (s) + 2H2O → 2CsOH(aq) + H2(g)
(3) التفاعل مع الهالوجينات
– السيزيوم معدن يتفاعل بقوة مع الهالوجينات لتشكيل هاليدات السيزيـوم.
– فهو يتفاعل مع الفلور، الكلور، البروم واليود ليشكل على التوالي فلوريد السيزيـوم، كلوريد السيزيـوم، بروميد السيزيـوم ويوديد السيـزيوم كما بالتفاعلات التالية:
2Cs(s) + F2(g) → CsF(s)
2Cs(s) + Cl2(g) → CsCl(s)
– وكذلك في حالتي البروم واليود يكون كما يلي:
2Cs(s) + Br2(g) → CsBr(s)
2Cs(s) + I2(g) → CsI(s)
(4) التفاعل مع الأحماض
– يذوب معدن السيزيوم بسهولة في حمض الكبريتيك المخفف كما بالتفاعل التالي:
2Cs(s) + H2SO4(aq) → 2Cs+(aq) + SO42- (aq) + H2(g)
استخدامات السيزيوم Uses of Caesium
(1) تعد مركبات السيزيوم من أهم المركبات في مجال الكيمياء العضوية، فمثلاً تستخدم كربونات السيـزيوم في الكيمياء العضوية من أجل توفير وسط أساسي للتفاعلات العضوية نتيجة انحلاله الجيد بالمذيبات العضوية إذ يستخدم في تفاعلات الأسترة، وفي تشكيل الحلقات الضخمة.
(2) علاوة على ذلك يستخدم يوديد السيزيوم في تصنيع مواشير مطيافية الأشعة تحت الحمراء.
(3) يستخدم هيدروكسيد السيـزيوم في المختبرات الكيميائية أحياناً كقاعدة لتفاعلات معينة مثل: التفاعل الحفزي لتشكيل مشتقات ألكانية من الألدهيدات والكيتونات.
(4) يستخدم فلوريد السيـزيوم في إزالة السيليكون من المركبات العضوية، وذلك نظراً لقوة الرابطة (F-Si) فيستعمل مع رباعي هيدروفوران THF وثنائي ميثيل فورماميد DMF ليهاجم مركبات السيليكون العضوية.
(5) تعمل مركبات السيزيوم عالية الكثافة كما بالصورة التالية على منع الغازات السامة من الارتفاع إلى السطح.
(6) يستخدم السيزيوم في الساعات الذرية، والتي تقيس الوقت حتى جزء من المليار من الثانية، هذه الساعات دقيقة للغاية لدرجة أنها لن تكسب أو تفقد أكثر من ثانية واحدة كل 300 عام.
– المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.