اليورانيوم Uranium – وقود المفاعلات النووية والقنابل الذرية
محتويات الموضوع
ما هو عنصر اليورانيوم Uranium؟
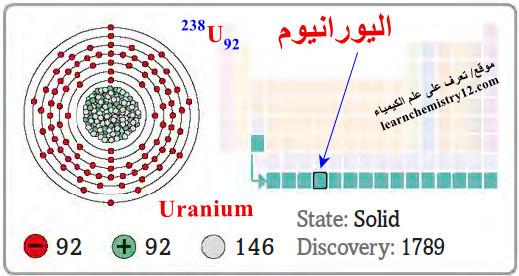
– اليورانيوم Uranium هو عنصر من عناصر الجدول الدوري: العدد الذري = 92 ، العدد الكتلي = 238
– الرمز الكيميائي لعنصر اليورانيوم يرمز له بالرمز: 238U92
– التوزيع الإلكتروني له: Rn]86 7s2 5f3 6d1]
– اليورانيوم هو فلز مشع أبيض فضي اللون.
– هو مصدر الطاقة المستخدمة في توليد الطاقة الكهربائية في كل محطات القدرة النووية التجارية الكبيرة، فبإمكان قطعة من اليورانيوم في حجم كرة المضرب إطلاق كمية من الطاقة تساوي كمية الطاقة التي تطلقها حمولة من الفحم الحجري يبلغ وزنها ثلاثة ملايين ضعف وزن قطعة اليورانيوم.
– ينتج أيضاً الانفجارات الهائلة لبعض الأسلحة النووية.
– ثاني أثقل عنصر موجود في الطبيعة بعد البلوتونيوم.
– كان اليورانيوم أول عنصر مشع معروف.
– يستخدم الشكل غير المستقر، اليورانيوم-235، كوقود في المفاعلات النووية وفي القنابل الذرية.
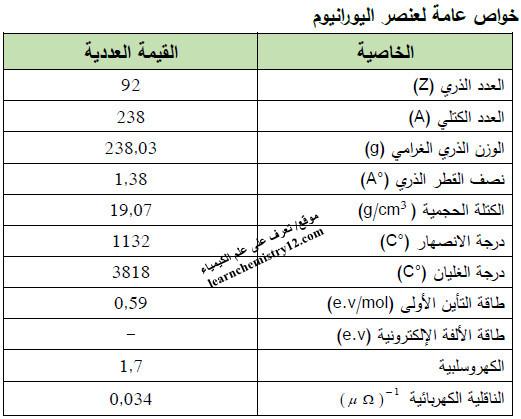
– الجدول التالي يوضح الخواص العامة لعنصر اليورانيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Uranium
– عرف اليورانيوم منذ القرون الوسطى في عدة مناسبات، ولاسيما في ساكسونيا بدون أن يلتفت إليه أحد وقد أطلق عليه (بتشبلند) المشتقة من الكلمة الألمانية بتش والتي تعني زفت، وظل أمداً طويلاً يعتقد بأنه لا يحتوي سوى معادن عادية كالحديد والزنك.
– جاء الكيميائي النمساوي (مارتن هنريش كلابروت) عام 1789م، فأعلن في أكاديمية برلين عن عثوره في البتشبلد على معدن جديد أطلق عليه اسم اليورانيوم وذلك تخليداً للحدث الفلكي الذي تمثل في اكتشاف الكوكب أورانوس Uranus.
– المصدر الأساسي لليورانيوم هو اليورانيت، ومن أهم أنواعه البتشبلد، الذي أكتشف فيه اليورانيـوم لأول مرة.
– من الخامات الرئيسية الأخرى اليورانوفان والكوفينيت والكارنونيت.
– قد يحتوي الحجر الجيري، الطفل والفوسفات على ترسبات قيمة من خامات اليورانيوم، بينما يحتوي الجرانيت عادة على كميات قليلة من اليورانيـوم.
– يوجد اليورانيوم أساساً في الصخور، ولكن بتركيزات منخفضة جداً، ففي المتوسط يوجد 26 رطلاً فقط من اليورانيـوم في كل مليون رطل من القشرة الأرضية.
– يوجد بتركيزات أقل من ذلك في الأنهار والبحيرات والمحيطات وغيرها من الأجسام المائية حيث يوجد ما بين 0.1 رطلاً و10 أرطال من اليورانيـوم في كل مليون رطل من الماء.
تحضير اليورانيوم Preparation of Uranium
– يتم تكسير الخام إلى قطع صغيرة وتجمع عن طريق الطفو باستخدام حمض الفوليك، ثم يتم تحميصها في الهواء حتى يتم تحويلها إلى الأكاسيد.
– بعد ذلك يتم تصنيفها في مزيج من حمض الكبريتيك وبرمنغنات البوتاسيوم حتى نتأكد من أكسدة اليورانيوم الموجود بالخام.
– ثم نقوم بترسيب اليورانيـوم بإضافة هيدروكسيد الصوديوم حتى يتحول إلى الصيغة غير الذائبة Na2U2O7 ويطلق عليها اسم الكعكة الصفراء.
– يضاف إليها حمض النتريك حتى يتحول إلى نترات اليورانيوم الذي يتم تمرير بخار الفلور عليه متحولاً إلى بخار من فلوريد اليورانيـوم UF4.
– ثم يتم استخلاص اليورانيوم النقي بواسطة الاختزال عن طريق عنصر الكالسيوم.
– يتم استخلاص نظائر اليورانيـوم أيضاً بطريقة مماثلة.
مركبات اليورانيوم Uranium Compounds
– تعد الأكاسيد UO2, UO3, U3O8 من أهم مركبات اليورانيوم.
(1) ثاني أكسيد اليورانيوم UO2
– يكون على شكل مسحوق أسود اللون، وهو عديم الذوبان في الماء والمحاليل القلوية
– يذوب بصعوبة في الأحماض باستشاء HNO3 الذي يتفاعل معه مشكلا نترات اليورانيل UO2(NO3)2 ويتحول UO2 بالتسخين في الهواء إلى U3O8.
(2) ثلاثي أكسيد اليورانيوم UO3
– هو مسحوق لابلوري برتقالي اللون يحضر بالتفكك الحراري لنترات اليورانيل UO2(NO3)2 في الدرجة 350Co كما بالتفاعل التالي:
2UO2(NO3)2 → 2UO3 + NO2 + O2
– يختزل UO3 بأكسيد الكربون في الدرجة بأكسيد الكربون في الدرجة 350Co كما يلي:
UO3 + CO → UO2 + CO2
– يمتص UO2 الرطوبة ويتحول بغليانه في الماء إلى UO3.H2O ويمكن كتابة صيغته بالشكل UO2(OH)2 أو H2UO4 ويتشكل أيضاً UO3.H2O الذي يتحول بالتسخين إلى 2UO3.H2O ويمكن كتابته بالشكل H2U2O7 وهو خواص مذبذبة يشكل مع القلويات أملاح اليورانات A2UO4 ومع الأحماض أملاح اليورانيل UO2+3 ذات اللون الأخضر المصفر.
(3) أوكتا أكسيد اليورانيوم U3O8
– ذو لون أبيض وهو الأكسيد الأكثر ثباتاً في الهواء من بين الأكاسيد الأخرى وهو طبيعي.
– يستعمل كمادة أولية لتحضير معظم الأكاسيد الأخرى بالتكليس.
– يمكن اعتبار U3O8 مزيجاً من الأكسيدين UO3 و UO2
– يتفاعل مع حمض الكبريت ذي درجة الأكسدة (6+) مشكلاً ملح كبريتات اليورانيـوم (4+) وملح كبريتات اليورانيل كما بالتفاعل التالي:
U3O8 + 4H2SO4 → U(SO4)2 + 2(UO2)SO4 + 4H2O
– يصادف U3O8 في الطبيعة كما يمكن تحضيره من UO3 و UO2 كما يلي:
– يتفكك بالتسخين في الهواء ابتداءً من الدرجة 900مo.
UO3 → U3O8 + 1/2 O2
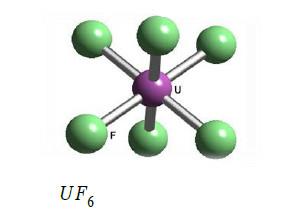
(4) سداسي فلوريد اليورانيوم UF6
– يعتبر هذا المركب أهم مركبات اليورانيوم وهذا بسبب استخدامه في فصل النظير عن النظائر الأخرى.
– يتحد اليورانيوم مع الفلور مشكلاً مركبات موافقة لدرجات الأكسدة (3+)، (4+)، (5+)، (6+) لليورانيوم.
– ينتج سداسي فلوريد اليورانيوم عن التفاعل المباشر بين اليورانيوم وكمية زائدة من الفلور أو بتأثير هذا الأخير على فلوريدات اليورانيـوم في درجة حرارة تقارب 400 مo، كما بالتفاعل التالي:
U + 6F → UF6
– يكون سداسي فلوريد اليورانيوم على شكل بلورات ثمانية الوجوه تقريباً، وهو مركب طيار.
– تنصهر هذه المادة عديمة اللون في الدرجة 641 مo وهي مادة سهلة التحول على غاز.
– يتميز بسهولة التحلل في الماء حيث يتحول إلى ثنائي فلوريد اليورانيل UO2F2
(5) خماسي كلوريد اليورانيوم UCl5
– هو من نواتج اليورانيوم ذات درجة الأكسدة (+5)
– يتم استحصال خماسي فلوريد اليورانيـوم وخماسي كلوريد اليورانيـوم، وهي مركبات طيارة وفي المحاليل المائية تتميأ كلياً، كما بالتفاعل التالي:
UCl5 + 3H2O→ HUO3 + 5HCl
(6) مركباته العضوية المعدنية
– يتم التحصل على المركبات العضو معدنية لليورانيـوم كما بالتفاعلات التالية:
Cp3UCl + MeLi → Cp3UCH3 + LiCl
tricyclopentadienyl → methyluranium
Cp3UCl + PrLi → Cp3UC3H3 + LiCl
tricyclopentadienyl → propyluranium
Cp3UCl + phLi → Cp3UC6H5 + LiCl
Tricyclopentadienyl → phenyluranium
(7) مركبات أخرى
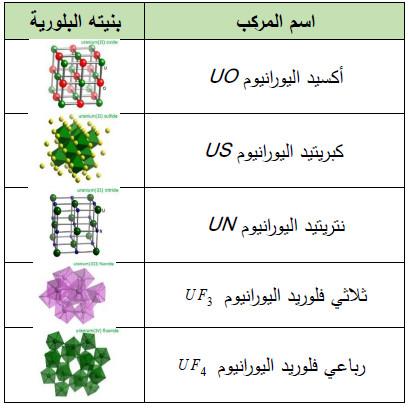
– الجدول التالي يوضح مركبات أخرى لهذا العنصر كما يلي:
الخواص الكيميائية لعنصر اليورانيوم Chemical properties of Uranium
– يتفاعل اليورانيوم مع العديد من العناصر والمركبات.
(1) التفاعل مع الهواء
– يتأكسد اليورانيوم بأكسجين الهواء والأزوت ويتشكل أثناء احتراقه في الأكسجين عدة أكاسيد وذلك في درجة حرارة °700C إلى °1000C كما بالتفاعل التالي:
3U + 4O2 → U3O8 (UO2 . 2UO3)
U + O2 → UO2
(2) التفاعل مع الماء
– اليورانيوم يتأكسد بالماء بالتسخين ويكون التفاعل بطيء، كما بالتفاعل التالي:
U + 2H2O → UO2 + 2H2
(3) التفاعل مع الهالوجينات
– يتفاعل اليورانيوم مع الهالوجينات ليعطي رباعي الفلوريدات ورباعي البروميدات ورباعي الكلوريدات كما بالتفاعلات:
U + 4F → UF4
U + 4Br → UBr4
– أما رباعي الكلوريد فيتشكل في وجود حمض كلور الماء HCl كما بالتفاعل التالي:
U + 4HCl → UCl4 + 2H2
(4) التفاعل مع الأحماض
– يتفاعل اليورانيوم مع حمض الكبريتيك كما التفاعل التالي:
U + 2H2SO4 → U(SO4)2 +2H2
(5) التفاعل مع الغازات
– يتفاعل اليورانيوم مع غاز الهيدروجين في درجة حرارة 250مo وبسرعة كما يلي:
U + 3H2 →2UH3
– كما يتفاعل مع غاز الأزوت في الهواء تحت °1200C كما يلي:
U + 1/2 N2 → UN
(6) التفاعل مع الفوسفور
– يتفاعل اليورانيوم مع الفوسفور في درجة حرارة مرتفعة كما بالتفاعل التالي:
3U + 4P → U3P4
(7) التفاعل مع الكربون
– يتفاعل اليورانيوم مع الفحم في درجة حرارة 800-1200مo، ويعطي UC2 و UC كما بالتفاعل التالي:
U + C → UC
(8) التفاعل مع الكبريت
– يتفاعل اليورانيوم مع الكبريت لينتج لنا US2 و U2S3 كما بالتفاعل التالي:
U + 2S → US2
(9) التفاعل مع السيليكون
– كما يتفاعل اليورانيوم مع السيليكون ليعطي لنا عدة مركبات وهي: USi5 , U2Si3 , USi3, USi2 , USi
– مثال:
U + 2Si → USi2
استخدامات اليورانيوم Uses of Uranium
(1) يعد اليورانيوم من المصادر الرئيسية للطاقة في كثير من الدول، حيث يمثل الطاقة الكهربائية المولدة بواسطة المحطات النووية ما يقارب %17 من مجموع الطاقة الكهربائية المنتجة في العالم.
(2) تعد الصناعة من أهم المجالات التي استفادت كثيرا من الاستخدامات المختلفة للنظائر المشعة وتمثل هذه الاستفادة أساساً في توفير الطاقة والمواد الخام والوقت والجهد.
(3) اليورانيوم مصدر أساسي للوقود النووي.
(4) تستخدم النظائر المشعة في تقنيات الطب النووي وفي تحضير المركبات الكيميائية والصيدلانية ولأغراض تشخيص الأمراض الخبيثة وأمراض الدماغ.
(5) يستخدم في البحث العلمي بغرض تحقيق التنمية.
(6) يستخدم اليورانيوم في تحليله في تحلية مياه البحر.
(7) في أوائل القرن العشرين، استخدم بعض المصنعين اليورانيـوم في طلاء الأوعية الزجاجية، لكنهم أدركوا لاحقًا أنه معدن ضار.
تأثير اليورانيوم على جسم الإنسان
– لا يشكل اليورانيوم خطراً على الصحة إلا في حالة دخوله إلى الجسم.
– بشكل عام لا يشكل التعرض الخارجي لأشعة (جاما) قلقاً رئيسياً لأن اليورانيـوم يصدر كمية صغيرة فقط من أشعة (جاما) المنخفضة الطاقة.
– أما التعرض لأشعة بيتا فلا يقلق إلا بالنسبة لاستعمالات المناولة المباشرة نظراً للتأثيرات الآثار الجلدية المحتملة.
– أما أهم طرق التعرض فهي تناول الطعام والماء المحتوي على نظائر اليورانيوم ابتلاعاً وكذلك استنشاق الغبار الملوث باليورانيـوم.
– يعتبر الاستنشاق عادة أكثر وسائل التعرض إقلاقا ما لم يكن هناك مصدر قريب للغبار المحمول بالهواء.
– اليورانيوم يدخل إلى الجسم استنشاقاً بسهولة أكبر منه في حال الابتلاع.
– ما يثير القلق الصحي الأكبر هو التلف الكلوي الذي تسببه سمية مركبات اليورانيـوم المنحلة، وقد تكون هذه التأثيرات عكوسه استناداً إلى مستوى التعرض.
– لا يعد اليورانيوم مادة كيميائية مسرطنة.
– أما الأثر المقلق فيخص اليورانيـوم الموجود في العظام، والذي قد يؤدي على سرطان العظام كنتيجة للإشعاع المتأين الذي يرافق نواتج الاضمحلال المشعة.
تأثير اليورانيوم على البيئة
– لقد سبب اليورانيوم مشكلات تناسلية في حيوانات المختبرات، وكذلك مشكلات نمائية لدى صغار الحيوانات ولكن ليس من المعلوم ما إذا كانت هذه المشكلات موجودة فيما يخص البشر.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان. أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson. – consultant Jack Challoner – Great Britain 2017