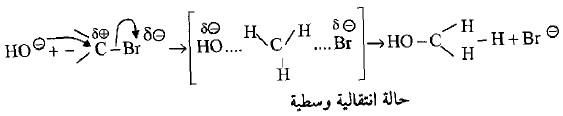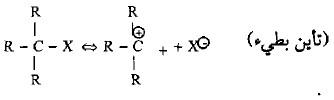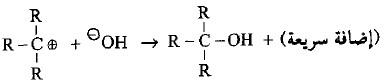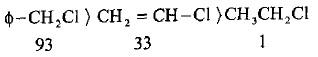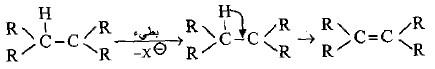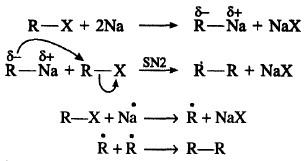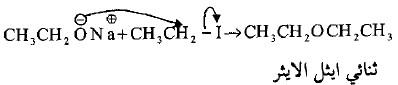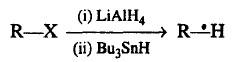تفاعلات هاليدات الألكيل
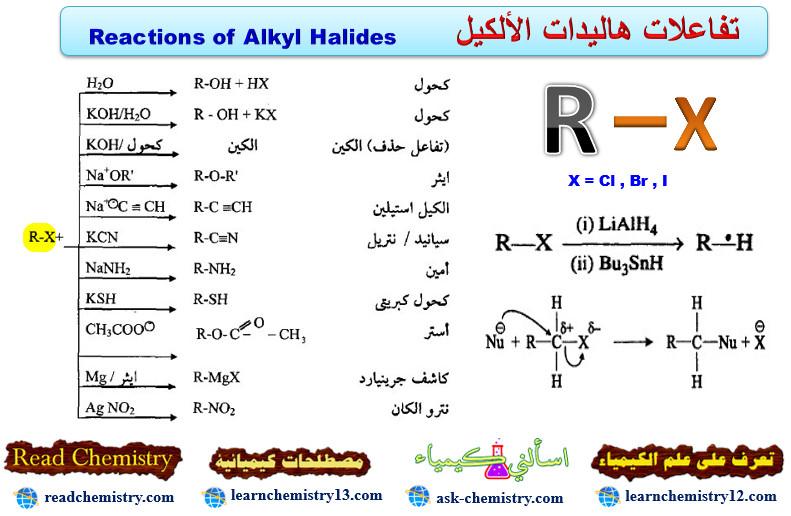
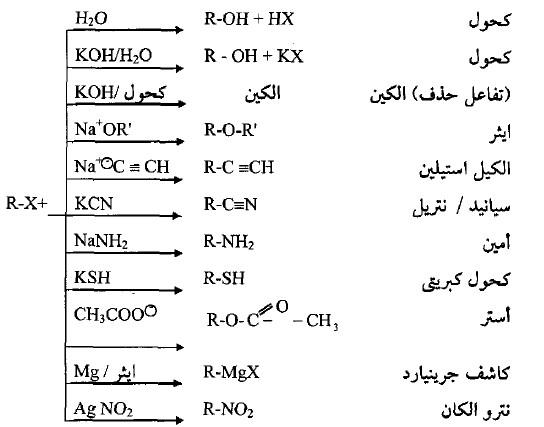
تفاعلات هاليدات الألكيل Reactions of Alky Halides
– في هذا الموضوع ستتم مناقشة جميع تفاعلات هاليدات الألكيل المشهورة مع المعادلات والشرح التفصيلي.
– تفاعلات هاليدات الألكيل توضح الخواص الكيميائية لها وهي كما يلي:
(1) تفاعلات الاستبدال النيوكليوفيلي Nucleophilic Substitution Reaction
– يعتبر تفاعل الاستبدال النيوكليوفيلي من أهم تفاعلات هاليدات الألكيل والذي يشتمل على مغادرة آيون الهاليد ذو السالبية الكهربائية العالية (ذرة مغادرة جيدة) واستبداله بكاشف نيوكليوفيلي –Au.
– لتمتع هاليدات الألكيل بالاستقطاب العالي (جزيئات قطبية) لذا فأن تفاعلاتها الاستبدالية تكون متعددة وبالتالي سوف تدخل في الكثير من التفاعلات والتحضيرات لعديد من المركبات العضوية.
– جميع التفاعلات أعلاه هي تفاعلات استبدالية عدا تفاعل الحذف لتكوين الألكين المقابل.
– تكون سرعة التفاعل للهاليد كما يلي: R-Cl < R-Br < R-I.
– كما تختلف ميكانيكية التفاعل الاستبدالي النيوكليوفيلي وفق صنف الهاليد حيث تدخل الهاليدات الأولية وبعض الهاليدات الثانوية الصغيرة هذا التفاعل بميكانيكية تختلف عن الهاليدات الثالثية وبعض الهاليدات الثانوية الكبيرة.
– فيما يلي شرحاً تفصيلياً عن كل ميكانيكية.
(أ) ميكانيكية الاستبدال النيوكليوفيلي من المرتبة الثانية (SN2)
– تتفاعل الهاليدات الأولية البسيطة مع القواعد القلوية لتكوين الكحول المقابل كما بالمعادلة التالية:
– في معظم تفاعلات الاستبدال فأن تبديل مجموعة معوضة بأخرى لا تتم بخطوتين بل يشارك كلا المتفاعلين في العملية الأولى والتي تبدأ بها المجموعة الجديدة حينما تقترب من الهاليد. لذلك فأن التفاعل هو تفاعل جزيئتين (bimolecidar reaction) والذي تكون سرعته طردية مع عدد جزيئات الجزيئتين المتفاعلين (التركيز ) وعدد جزيئات الناتج (تفاعل من المرتبة الثانية).
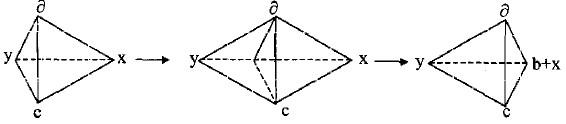
– من الناحية الفراغية نجد أن الكاشف النيوكليوفيلي المهاجم وهو مجموعة الهيدروكسيل. ونتيجة لتنافر شحنته مع الهاليد المستقطب يهاجم من الجهة المعاكسة لمغادرة الهاليد. مما يؤدي إلى حالة وسطية يكون فيها كلاً من الكاشف النيوكليوفيلي والهاليد مرتبطان بذرة الكربون وكما يلي:
– تدعى هذه الميكانيكية بالاستبدال النيوكليوفيلي من المرتبة الثانية ويرمز لـه بـ (Substitution Naclophilic bimolecular SN2)
– تتضمن هذه الميكانيكة تكوين حالة انتقالية تكون فيها الذرات أو المجاميع المرتبطة بذرة الكربون في مستوى واحد وبزاوية مقدارها o120 ، ويكون كلاً من المجموعة المهاجمة والمجموعة المغادرة في مستقيم واحد عمودي على المستوى (إنكولد Ingold) .
– أن تكوين الحالة الوسطية الانتقالية يتطلب طاقة أقل مما تتطلبه عملية التفكك لرابطة C-Br (بولاني Polany)
– تجدر الاشارة إلى أن هنالك دلائل قوية على صحة هذه الميكانيكية عندما تكون ذرة الكربون غير متناظرة Asymmetric C-atom) حيث وجد أن هنالك انقلاباً في الترتيب الفراغي للمركب الناتج مما يدل على أن تكوين الرابطة الجديدة قد حدث من الجهة المعاكسة لكسر الرابطة القديمة (انقلاب فالدن Walden Inversion)
– على العموم فأن سرعة التفاعل للهاليدات تكون وفق صنف الهاليد: 1o > 2° > 3°
(ب) ميكانيكية الاستبدال النيوكليوفيلي من المرتبة الأولى SN1
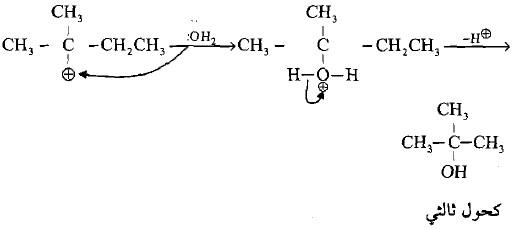
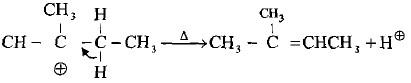
– عند تفاعل الهاليدات الثالثية وبعض الهاليدات الثانوية الكبيرة مع الكواشف النيوكليوفيلية فأن الإعاقة الفراغية تلعب دوراً مؤثراً وواضحاً في تحديد مسار التفاعل حيث لا يمكن للكاشف النيوكليوفيلي أن يهاجم ذرة الكربون (نتيجة للإعاقة الفراغية إلا بعد أن يحدث التأين ويغادر الهاليد لتكوين الكاربوكتيون في خطوة بطيئة (الخطوة المحددة لسرعة التفاعل).
– في الواقع فأن مجاميع الألكيل سوف تزيد من سرعة التأين لأن ذلك سيزيد من استقرارها ويقلل من الازدحام الفراغي حول ذرة الكربون ويجعل الزوايا بينها 120o بدلاً من أقل 109.5o بعد مغادرة ذرة الهالوجين الكبيرة.
– هنا يأتي دور النيوكليوفيل في الهجوم النيوكليوفيلي على ذرة الكربون الموجبة. ومن نفس الجهة التي غادرها الهالوجين لأن الجهة الأخرى مكتظة بمجاميع الألكيل ويتم التفاعل بسرعة كبيرة لتكوين الناتج النهائي.
– تحتاج عملية التأين الأولى إلى طاقة تنشيطية كبيرة لذا يتم الاستعانة بمذيب قطبي قوي لإتمامها مثل الماء أو حمض الفورميك.
– لذلك فأن سرعة التفاعل في هذه الميكانيكية سوف تعتمد على تركيز الكاربوكتيون فقط والمتكون نتيجة خطوة التأين الأولى البطيئة وهذا الأمر يؤدي بالتفاعل إلى أن يعتبر من المرتبة الأولىSN1 (Substitution, Nucleophilic unimolecular).
– كما ستكون فعالية الهاليدات تجاه هذه الميكانيكية هو 3o > 2o > 1o.
– لم يلاحظ أي دور للعوامل الفراغية في ميكانيكية SN1 في حالة الهاليدات الثالثية التي تحتوي على ذرة كربون غير متناظرة.
– إذا كان الافتراض أن المجاميع الثلاثية للكاربوكتيون سوف تدخل في شكل مستوى فأن الهجوم النيوكليوفيلي سيكون متساوياً من الأعلى ومن الأسفل مما يؤدي إلى تكوين مزيج راسيمي ولكن الواقع يؤكد تكوين شكل واحد من المركبات الفعالة بصرياً وهذا يعتمد على تركيب الهاليد والمذيب المستخدم.
– يعاني الكاربوكتيون المتكون في الخطوة الأولى من عملية إعادة ترتيب إذا كان أولياً أو ثانوياً ضماناً لاستقراره وثباته، لذا فقد تختلف الكحولات الناتجة من التفاعل عن تلك المتوقعة.
– ترتبط المجموعة النيوكليوفيلية مع ذرة كربون غير تلك التي غادرها الهالوجين السالب كما في حالة كلوريد نيو بنتيل.
– كذلك من المتوقع أن يصاحب تفاعل الاستبدال أعلاه تفاعل حذف لتكوين الألكين المقابل سيما إذا زادت حرارة التفاعل أو تم تسخين دورق التفاعل إضافة إلى طبيعة المذيب.
– عندما يكون الكاشف النيوكليوفيلي هو المذيب نفسه (الماء أو الكحول) فلا مجال للاعتماد على سرعة التفاعل وتركيز الكاشف، لذا فأن مرتبة التفاعل تسمى حينذاك (المرتبة الأولى الكاذبة). وليس من الضروري أن تكون سرعة التفاعل معتمدة على تركيز جزيئة واحدة.
– فيما يلي قيم الاستقرار لبعض الكربوكاتيونات والتي تزداد بزيادة عدد مجاميع الألكيل المرتبطة بذرة الكربون الموجبة.
– يكون تأثير الرنين (التبادل) واضحاً وكبيراً في تفاعلات ميكانيكية SN2 بالرغم من الحالة الخماسية الوسطية لذا نجد أن الكربوكاتيونات التالية تختلف في درجة استقرارها باختلاف الحالة الرئينية.
(2) تفاعلات الحذف – β-Elimination Reactions β
– تعتبر أيضاً تفاعلات الحذف من أشهر تفاعلات هاليدات الألكيل
– يصحب تفاعلات الاستبدال النيوكليوفيلية في الغالب تفاعلات حذف الجزيئة هاليد هيدروجين سيما في الهاليدات الثالثية.
– تزداد نواتج الحذف على نواتج الاستبدال كلما زادت قابلية المجموعة للمغادرة وزيادة سالبيتها الكهربائية مثل مجموعة الأمونيوم الرباعي NR3+ – (حذف هوفمن).
– سميت تفاعلات الحذف هذه بتفاعلات حذف – β لأن رابطة الهيدروجين التي سوف تكسر هي في الموقع المجاور (-β) للذرة أو المجموعة المغادرة.
– أما الحذف الذي يتم من نفس الذرة فيدعى حذف (α) مثل تكوين الكاربين ()
– تتضمن هذه التفاعلات مايلي:
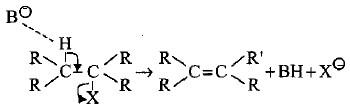
(أ) تفاعلات حذف تعتمد على تركيز جزيئة واحدة (Elimination unimolecular E1)
– هذا التفاعل E1 هو تفاعل حذف معاكس لإضافة SN1 تماماً حيث يتم التأين أولاً بخطوة بطيئة (محددة لسرعة التفاعل) لتكوين الكاربوكتيون الذي يستقر من خلال حذف ذرة الهيدروجين المجاورة (β) لإعطاء الألكين المقابل.
– يشمل هذا الحذف الهاليدات الثالثية.
(ب) تفاعلات حذف تعتمد على تركيز جزيئتين (Elimination Bimolecular E2)
– يعاكس هذا التفاعل إضافة SN2 حيث لا يتضمن الحالة الوسطية تكوين کاربو كاتيون وإنما حالة وسطية ثنائية الجزيئة.
– يتم الحذف لكل من الهالوجين والهيدروجين في وقت واحد وكما يلي:
– تتفاعل الهاليدات الأولية والثانوية وفق ميكانيكية حذف E2 لكونها لا تتأين إلى الكاربوكتيون المقابل.
(جـ) حذف E1 مع القاعدة المقترنة El conjugated Base) E1CB)
– هذا الحذف يعتمد على تركيز جزيئة واحدة بوجود القاعدة المرافقة أو المقترنة التي تؤثر في التوازن الكيميائي للتفاعل.
– لهذه الميكانيكية احتمالين أو مسارين كما يلي:
أولاً/ إذا كان معدل سير التفاعل العكسي K2 < K1 فأن التفاعل سيكون عكسياً. ويرمز للحذف E1CB]R] حيث يعني R أن التفاعل عكسياً (Reversible).
ثانياً/ أما إذا معدل سير التفاعل غير عكسياً أي ان K1 < K2 . يرمز للتفاعل بأنه غير عكسي E1CB]I] والحرف I يرمز لعدم انعكاس التفاعل (Irreversible).
(3) تفاعل الهاليدات مع فلز المغنيسيوم (تحضير كاشف جربنيارد Gignard Reagent)
– تتفاعل الهاليدات الأليفاتية والأروماتية مع فلز المغنيسيوم بوجود الايثر الجاف لتكوين مركب عضوي فلزي يدعى هاليد مغنيسيوم الألكيل أو الأريل أو کاشف جرينيارد نسبة إلى العالم الفرنسي جرينيارد (Grignard).
– هذه الكواشف لها القدرة على التفاعل مع مركبات الكاربونيل مثل الألدهيدات والكيتونات والأسترات لتكوين الكحولات الأولية والثانوية والثالثية.
(4) تفاعل الهاليدات مع فلز الصوديوم (تفاعل فرتز -Wartz Reaction)
– بوجود الصوديوم والحرارة العالية، فأن هاليدات الألكيل سوف تزدوج وبوجود مذيب كاربوني إلى الألكان الحاوي على ضعف عدد ذرات كربون الهاليد.
– يحبذ أن يتم التفاعل باستخدام هاليد واحد ضماناً لإنتاج ألكان مضاعف نقي.
– أما في حالة استخدام هاليدين مختلفين فأن نواتج التفاعل تكون متعددة يصعب فصلها لتقارب درجات غاليانها.
(5) تفاعلات هاليدات الألكيل مع الألكوكسيدات
– تتفاعل الهاليدات الأليفاتية مع أملاح الكوكسيد الصوديوم أو مع أكسيد الفضة في تفاعل ازدواج لتكوين الايثرات المقابلة كما يلي:
(6) تفاعلات هاليدات الألكيل مع الأمونيا والأمينات الأليفاتية
– تتفاعل الأمينات بجميع أصنافها مع الهاليدات الأليفاتية حيث تقوم الهاليدات بإضافة مجموعتها الألكيلية إلى الأمين المتفاعل ليرفع صنف الأمين إلى الصنف الأعلى التالي مع تحرير هاليد الهيدروجين المقابل كما يلي:
(7) تفاعلات هاليدات الألكيل مع سيانيد البوتاسيوم
– يضاف محلول سيانيد البوتاسيوم إلى الهاليدات الألكيلية حيث يتكون مركب سيانيد الألكيل (النتريل) والذي سيكون بزيادة ذرة كربون واحدة عن المركب المتفاعل حيث يمكن أن يتحلل مائياً (بوجود الحمض) إلى الحمض الكربوكسيلي كما يلي:
(8) تفاعلات هاليدات الألكيل مع الأستيليدات
– يتكون آيون الاستيليد من تفاعل الأستيلينات الحاوية على ذرة هيدروجين (α) المرتبطة مباشرة بذرة كربون الرابطة الثلاثية مع قاعدة قوية جداً مثل أميد الصوديوم في الأمونيا السائلة NH3/NaNH2 كما يلي:
– يمكن للهاليدات الأليفاتية بحكم قطبيتها العالية التفاعل مع آيون الأستيليد وتضيف مجموعة الألكيل له بغية زيادة عدد ذرات كربون السلسلة مع الحفاظ على الرابطة الثلاثية والتي تعتبر طريقة أساسية لزيادة طول السلسلة للألكانيات.
– يمكن للأستيلين أن يضيف مجموعتي الكيل لاحتوائه على ذرتي هيدروجين طرفية.
– وضحنا فيما سبق أشهر تفاعلات هاليدات الألكيل يمكنك أضافة اى تفاعل مع هاليدات الأكيل فى التعليقات وسنقوم بشرحه هنا.
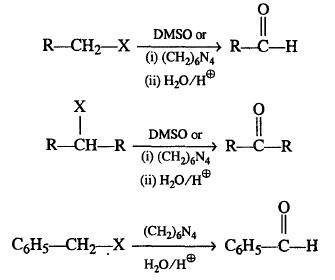
(9) تفاعل أكسدة هاليدات الألكيل
– تتأكسد هاليدات الأكيل الأولية والثانوية أنما هاليدات الألكيل الثالثية فلا تتأثر بالأكسدة.
– تتأكسد هاليدات الألكيل الأولية وتعطي ألدهيدات، أما هاليدات الألكيل الثانوية فتعطي كيتونات.
– نشاط تفاعل الأكسدة هنا يعتمد على عدد ذرات الهيدروجين الموجود في ألفا-كربون لهاليد الألكيل.
– تستخدم العوامل المؤكسدة الموجودة على الأسم فى التفاعلات الآتية وهي كما يلي:
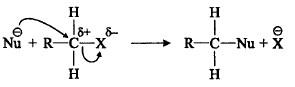
(10) تفاعل اختزال هاليدات الألكيل
– تختزل هاليدات الألكيل وتعطي ألكات فى وجود LiAlH4 كعامل حفاز كما بالتفاعل التالي:
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA.
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States