تفاعلات الكربوهيدرات أحادية التسكر Monosaccharides Reactions
في هذا الموضوع سيتم مناقشة جميع تفاعلات الكربوهيدرات المشهورة للسكريات الأحادية (أحادية التسكر) ولكن قبل الخوض في تفاعلات الكربوهيدرات نلقي نظرة سريعة على الخواص الفيزيائية.
الخواص الفيزيائية لأحادية التسكر Physical properties of monosaccharides
– نتيجة لوجـود عدد كبير من مجموعات الهيدروكسيل القطبية، نجد أن جميع السكريات الأحادية تذوب في الماء، والمذيبات القطبية الأخرى ولكنها لا تذوب في المذيبات غير القطبية.
– إن وجود عدد من مجموعات الهيدروكسيل يجعل الجزيئات ترتبط ببعضها البعض عن طريق روابط هيدروجينية قوية لدرجة أن السكريات البسيطة لها درجات غليان عالية.
وكمثال على ذلك جليسرالدهيد يغلي عند 150o تحت ضغط منخفض 0.8mm بينها يتفكك الجزيء قبل أن يصل إلى درجة الغليان وذلك عند الضغط الجوي، مما يدل على أن درجة غليانه عالية جداً.
– جميع السكريات الأحادية لها طعم حلو، ومعظمها مواد صلبة بيضاء.
تفاعلات الكربوهيدرات أحادية التسكر Monosaccharides Reactions
من أهم تفاعلات الكربوهيدرات أحادية التسكر:
(1) الاختزال Reduction
(2) الأكسدة Oxidation
(3) التفاعل مع فينل – هيدرازين Phenylhydrazine
(4) تحضير كيلياني وفيشر Killani-Fischer synthesis
(5) تحضير رف وفوهل Ruff-Wohl synthesis
(6) تخمر الكربوهيدرات أحادية التسكر.
وسوف نقوم بشرح كلاً من تفاعلات الكربوهيدرات السابقة بالتفصيل كما يلي:
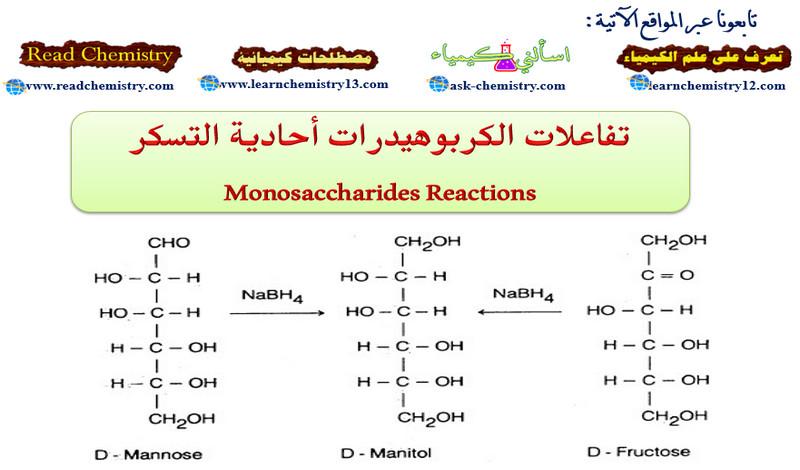
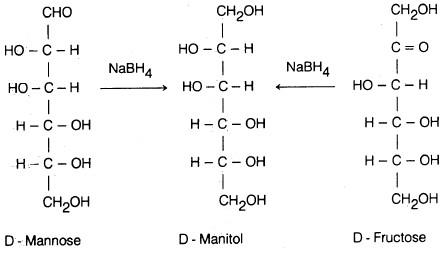
(1) الاختزال Reduction
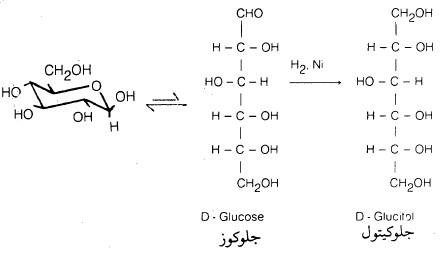
– هناك طرق مختلفة لاختزال أحادية التسكر بسهولة إلى الكحولات المقابلة. فمثلا يختزل (D) – جلوكوز إلى كحول (D) – جلوكيتول (يسمى قديماً بـ (D – سوربيتول)، بواسطة الهيدروجين في وجـود النيكل كعامل مساعد.
وربما يحدث الاختزال على الكمية القليلة من السلسلة المفتوحة والتي توجد بدورها في حالة اتزان مع الشكل الحلقي، وهذه قاعدة عامة لمعظم تفاعلات السكريات.
کما أن (D) – مانوز ممكن اختزاله بواسطة بوروهيدريد الصوديوم إلى الكحول المقابل (D) – مانيتول.
(2) الأكسدة Oxidation
– تتـأكـسـد السكـريات إلى أحماض، حيث إن الألدهيدات والكيتونات عديدة الهيدروكسيل تختلف عن التي لا تتوافر فيها مجموعة OH – وذلك في سهولة أكسدتها.
– تختلف طبيعة ناتج الأكسدة باختلاف العامل المؤكسد.
– وعلى هذا فالألـدوزات والكيتـوزات تختزل محلول فهلنج وترسب من، منه أكسيد النحـاسـوز الأحمـر ومن هنـا تعـرف بالسكريات المختزلة.
– كما تجدر الإشارة إلى أن السكريات المختزلة هي السكريات التي تحتوي على ألفا ـ هيدروكسي الدهيد أو ألفا ـ هيدروكسي كيتون حر أو وحدة هيمي أسيتال أو هيمي كيتال. وهذا بالطبع يشمل جميع الكربوهيدرات أحادية التسكر.
– أما الكربوهيدرات قليلة أو عديدة التسكر فإنه يمكن أن تكون سكريات مختزلة أو غير مختزلة وبمعنى آخر ممكن أن تختزل أو لا تختزل محاليل تولينز، بندكت وفلنج (Tollen’s, Benedict and Fehling)
– تعرف السكريات غير المختزلة بأنها تلك السكريات التي تحتوي على وحدة أسيتال أو كيتال.
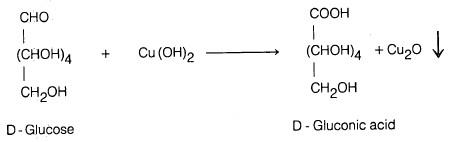
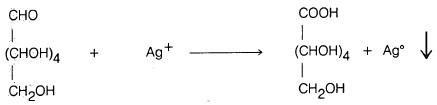
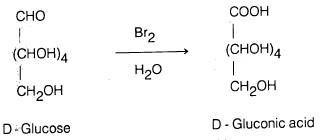
– كذلك فإن الكـربـوهيدرات أحادية التسكـر لها القدرة على اختزال نترات الفضة النشادرية حيث ترسب الفضة على هيئة مرآة فضية على جدار انبوبة الاختبار (اختيار تولینز، كما أشرنا سابقاً) وتتأكسد هي إلى حمض الجلوكونيك.
– كما أنه يمكن أكسدة الألدوزات إلى الحمض الكربوكسيلي المقابل بواسطة البروم أو اليود في وسط قاعدي.
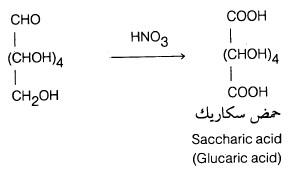
– أما عند استخدام مواد مؤكسدة قوية مثل حمض النيتريك الدافيء فإنه بالإضافة إلى تأكسد المجموعة الألدهيدية أو الكيتونية، تتأكسد أيضاً المجموعة الكحولية الطرفية إلى مجموعة كربوكسيلية. فمثلا يتأكسد الجلوكوز بواسطة حمض النيتريك إلى حمض ثنائي القاعدة يعرف بحمض سكاريك (Saccharic acid)
أما الفركتوز فيتأكسد بحمض النيتريك مكوناً مخلوطاً من حمض ميزو طرطريك وحمض جليكوليك.
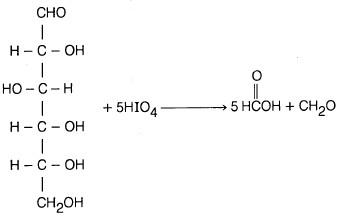
وأخيرا يجب التنويه على أن حمض بيريوديك يؤكسد السكريات حيث إنه يكسر الرابطة بين ذرتي الكربون المتجاورتين التي تحمل كل منها مجموعة هيدروكسيل . فمثلاً جزيء الجلوكوز يعطي خمسة جزيئات من حمض الفورميك (حمض النمل) وجزيء فورمالدهيد والذي ينتج عن ذرة الكربون رقم (6).
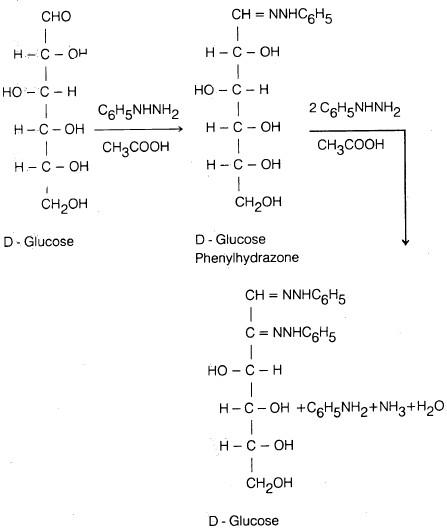
(3) التفاعل مع فينل – هيدرازين Phenylhydrazine
تتفاعل الكربوهيدرات أحادية التسكر مع فينيل هيدرازين في وجود حمض الخل فمثلاً:
- يتفاعل الجلوكوز مع فينل – هيدرازين، ليعطي في الخطوة الأولى فينل – هيدرازون ويكون التفاعل على ذرة الكربون رقم (1).
- ثم يؤكسد الجزيء الثاني من فينل – هيدرازين مجموعة الكحول الثانوية المتصلة بذرة الكـربـون رقم (2) إلى مجموعة كربونيل .
- يلي ذلك تفاعل جزيء ثالث من فينل. هيدرازين مع مجموعة الكربونيل التي تكونت ليعطي مشتق ثنائي ـ هيدرازين، يعرف باسم جلوكوزازون (Glucosazone). هذا الأوزازون يوجد على شكل بلورات صفراء.
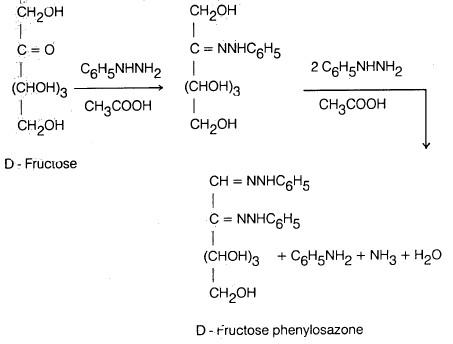
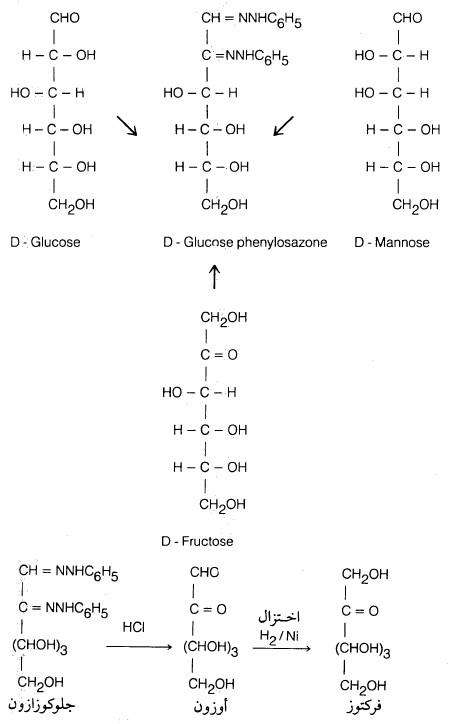
– كما يتفاعل الفركتوز مع فينل – هيدرازين ليعطي فركتوزازون (Fructosazone) والذي يشبه جلوكوزازون وذلك لأن الذرتين الداخلتين في التفاعل هما رقم (1)، (2)
– أما باقي الجزيء فلا يتم عليه أي تفاعل. وبالنظر إلى الصيغة الفراغية للجلوكوز والفركتوز نجد أن ذرات الكربون رقم (3)، (4) ورقم (5) متشابهة فراغياً في كل منها.
– ولإيضاح الصورة السابقة في تشابه ناتج الجلوكوز والفركتوز، نجد أن D- مانوز يتفاعل كذلك مع فينل هيدرازين ليعطي الناتج نفسه وذلك بسبب التشابه مع الفركتوز والجلوكوز في الوضع الفراغي لذرات الكربون رقم 3، 4 ورقم 5 .
– کما انـه يمكن تحويل الجلوكوز إلى فركتوز عن طريق تحويل الجلوكوز إلى الأوزازون ثم يسخن بعـد ذلك مع حمض الهيدروكلوريك المركز، فيتحلل مائيا إلى الأوزون (Osone) الذي يعطي عند اختزاله فركتوز وذلك لسهولة اختزال المجموعة الألدهيدية مقارنة بالمجموعة الكيتونية.
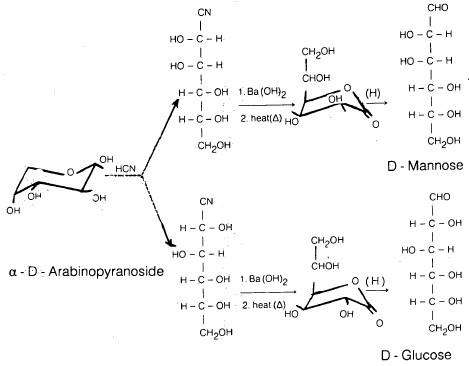
(4) تحضير كيلياني وفيشر Killani-Fischer synthesis
– وهذا التفاعل أهميته تكمن في زيادة عدد ذرات الكـربـون في أحادية التسكر.
– يتفاعل الألدوز مع حمض الهيدروسيانيك ليكون السيانوهيدرين وبذلك تتحقق في الخطوة الأولى زيادة عدد ذرات الكربون في الألدوز الأصلي بذرة واحدة.
– بعد ذلك يتم تحليل السيانوهيدرين مائياً بواسطة هيدروكسيد الباريوم .
– ثم يعامل ملح الباريوم الناتج بحمض الكبريتيك المخفف.
– ينتج عن ذلك الحمض الكربوكسيلي الذي بدوره يتحول إلى لاكتون الحمض عن طريق التسخين .
– يتم اختزال هذا اللاكتون بواسطة مملغم الصوديوم والكحول، أو بواسطة بوروهيدريد الصوديوم المائي ليتحول إلى الألدوز والذي تزيد فيه عدد ذرات الكربون بذرة واحدة عن الألـدوز الـذي بدء به التفاعل.
– بهذه الطريقة يتم تحويل الألدوبنتوزات إلى ألـدوهـكـزوزات، وكذلك يتم تحويل الألدوهكزوزات إلى ألدوهبتوزات ، وهكذا.
– وكمثال على ذلك يتم تحويل D – أرابينوز إلى مخلوط من D – جلوكوز، و D – مانوز.
(5) تحضير رف وفوهل Ruff-Wohl synthesis
– الهدف من هذا التفاعل هو إنقاص عدد ذرات الكربون في أحادية التسكر
– وهذه الطريقة عكس الطريقة السابقة (تحضير كيلياني وفيشر (Killani-Fischer synthesis التي تعمل على زيادة عدد ذرات الكربون في أحادية التسكر.
– حيث يتم تحويل الألدوهكسوزات إلى الدوبنتوزات وذلك عن طريق إنقاص عدد ذرات الكربون بذرة واحدة وممكن أن يتم ذلك بإحدى الطريقتين الآتيتين:
(أ) تحضير رف Ruff synthesis
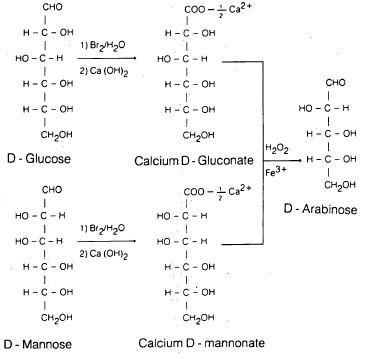
– تتـم أكسـدة الألـدوهـكسـوز بمـاء الـبروم إلى الحمض الكـربـوكسيلي، الذي يحول فيما بعد إلى ملح الكالسيوم الذي يؤكسد بواسطة فوق أكسيد الهيدروجين مع استخدام ملح الحديد كعامل مساعد إلى حمض ألفا ـ كيتوني.
– هذا الناتج الأخير يفقد ثاني أكسيد الكربون بسهولة عند التسخين وبذلك يحقق كسر الرابطة بين ذرة الكربون رقم (1)، (2)، ومن ثم ينتج الألدوبنتوز.
– بالرغم من أن الناتج النهائي لهذا التفاعل لا يتم بنسبة عالية، إلا أن هذه الطريقة مفيدة لتحضير بعض ألدوبنتوزات.
– ولكن لسوء الحظ هذه الطريقة غير صالحة لتحويل الألدوينتوزات إلى ألدونتروزات، وذلك بسبب انخفاض مردود النواتج. نجد أنه في مثل هذا التفاعل:
يفقد التماثل عند ذرة الكربون رقم (2) وعليه يمكن تحويل كل من D – جلوكوز وكذلك D – مانوز واللذان يختلفان فقط عند ذرة الكربون رقم (2) إلى D – أرابينوز.
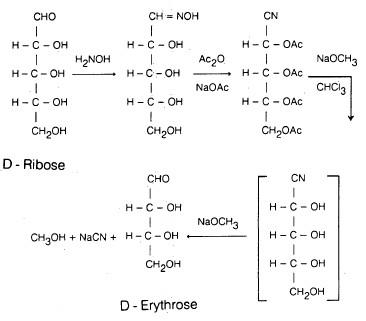
(ب) تحضير فوهل Wohl synthesis
– يتم بهذه الطريقة الحصول على ناتج مشابه لما حصل في الطريقة السابقة. حيث يتم تحويل الدوهكسوزات إلى الدوبنتوزات. كما يتم بهذه الطريقة تحويل الدوبنتوزات إلى الدونتروزات .
-هذه الطريقة هي بشكل عام عكس طريقة كيلياتي – فيشر. حيث تتم كما يلي:
- تحويل الدوز إلى أوكسيم (Oxime) وذلك بمعاملته بهيدروكسيل أمين .
- يعامل الناتج بحمض الخل اللامائي وخلات الصوديوم لاستلة مجموعات الهيدروكسيل،
- ثم يتم انتزاع جزيء ماء من المركب فتتحول مجموعة الأكسيم إلى نيترايل. والذي بدوره يعـامـل بنـترات الفضـة النشـادرية أو بمحلول ميثوكسيد الصوديوم فتتحلل مجموعات الاستر مائياً.
- كما يفقد جزيئاً من حمض الهيدروسيانيك.
وبذلك يتكون الدوز ينقص عن الألدوز الأصلي بذرة كربون واحدة.
– وكمثال على ذلك يمكن تحويل D – رايبوز إلى D – أريثروز.
(6) تخمر الكربوهيدرات أحادية التسكر
– التخمر يحدث فقط على السكريات التي تحتوي على ثلاث أو ست أو تسع ذرات من الكربون في الجزيء الواحد.
– فمثلاً يتخمر D – جلوكوز بسهولة عند درجة ٢٠°م إلى 30oم بواسطة إنزيم الزيميز الموجود في الخميرة.
– وأهم نواتج التخمر هو الكحول الإيثيلي وثاني أكسيد الكربون.
المراجع: كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان. والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية