السيلينيوم Selenium – الخواص الفيزيائية والكيميائية للسيلينيوم
محتويات الموضوع
ما هو عنصر السيلينيوم Selenium؟
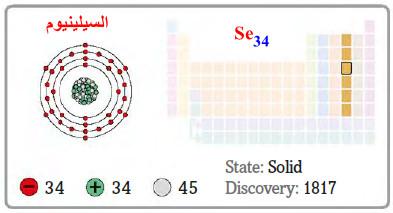
– السيلينيوم هو عنصر من عناصر الجدول الدوري: العدد الذري = 34 ، العدد الكتلي = 79
– الرمز الكيميائي لعنصر السلينيوم يرمز له بالرمز: 79Se34
– التوزيع الإلكتروني له: Ar]18 4s2 3d10 4p4]
– السيلينيوم لافلز يوجد في صورتين أصليتين تعرف إحداهما باسم السلينيوم الفلزي وهي الصورة الثابتة.
– عند تسخين هذه الصورة في أنبوبة مقفلة تتسامى إلى بلورات سوداء اللون، تستخدم في صنع بعض الخلايا الضوئية.
– أما الصورة اللافلزية للسيلينيوم فيتم الحصول عليها عند السماح للسلينيوم المرسب بالتماس مع مذيب مثل الكحول فيتحول السلينيوم إلى بلورات حمراء من السلينيوم اللافلزي.
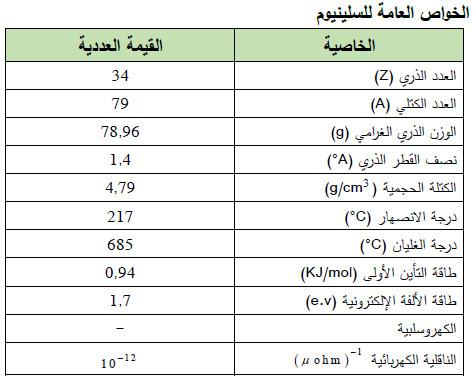
– الجدول التالي يوضح الخواص العامة لعنصر السلينيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Selenium
– اكتشف من قبل (Berzelius) في السويد سنة 1817م.
– اشتق اسمه من اليونانية Selene بمعنى القمر نظراً لكونه يوجد دائماً مع عنصر الذي أخذ اسمه من آلهة الأرض، أي كالأرض والقمر لا يتفرقان.
– يوجد السيلينيوم بالشكل الطبيعي في القشرة الأرضية بنسبة 5-10% ذرة.
– كما يوجد في النباتات يوجد بنسبة %2.5 ويغلب وجودها على هيئة سلينيدات لبعض الفلزات وهي: تشبه الكبريتيدات ومن أمثلتها سلينيدات الرصاص PbSe وسلينيد النحاس Cu2Se وسلينيد الفضة Ag2Se وتوجد أحيانا مختلطة بخامات الكبريتيات.
– وفي المنشآت النووية معبئة مثل المفاعلات النووية ومنشآت معالجة الوقود النووي المستنفذ.
– معدن Berzelianite يحتوى على سيلينيد النحاس Cu2Se
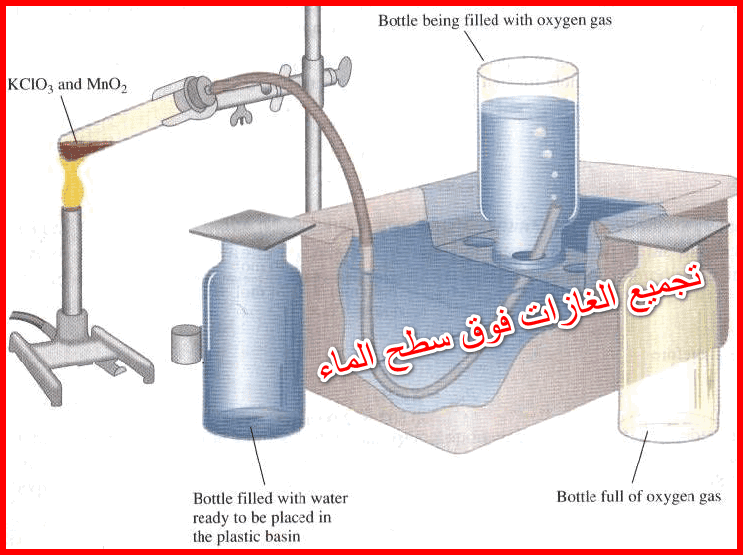
طرق تحضير السيلينيوم Preparation of Selenium
– يتم تحضير السيلينيوم التجاري بشكل عنصر رمادي اللون بإرجاع السيليكا بكربيد الكالسيوم، وذلك بالتسخين في فرن كهربائي كما بالمعادلة الآتية:
2SiO2 + 2CaC2 → 3Si + 2CaO + 4CO
الخواص الكيميائية لعنصر السيلينيوم Chemical properties of Selenium
(1) التفاعل مع الأكسجين
– يحترق السيلينيوم في الهواء بلهب أزرق مكونا أكسيد السلينيوم كما بالمعادلة الآتية:
Se + O2 → SeO2
(2) التفاعل مع الهالوجينات
– يتفاعل السيلينيوم مباشرة مع الهالوجينات.
– ومن أمثلة مركبات السيلينيوم مع الهالوجينات سداسي السيلينيوم SeF6 ورباعي كلوريد السلينيوم SeCl4 ورباعي بروميد السلينيوم SeBr4
– وهو يختلف عن الكبريت في أنه يكون مع اليود أحادي يوديد السيلينيوم Se2I2 ورباعي يوديد السيلينيوم SeI4
(3) مع حمض النيتريك
– يتأكسد بحمض النيتريك المركز حتى الحموض كما بالمعادلة الآتية:
3Se + 4HNO3 → 3SeO2+2H2O + 4NO
(4) التفاعل مع القواعد
– يتفاعل السيلينيوم مع القواعد بالتسخين كما بالمعادلة الآتية:
3Se + 6KOH → 3K2Se+ K2SeO3 + 3H2O
(5) التفاعل مع الهيدروجين
– يتفاعل السلينيوم مع الهيدروجين مكوناً سلينيد الهيدروجين H2Se كما بالمعادلة الآتية:
Se + H2 → H2Se
– ومن جهة أخرى نجد أن السلينيوم لا يتفاعل مع الماء ولا مع الأحماض الممددة.
استخدامات السيلينيوم Uses of Selenium
– ثمة عدة تطبيقات صناعية يتميز بها السيلينيوم وهي كما يلي:
(1) يستخدم في الخلايا الضوئية والخلايا الشمسية ومقاييس التعرض لغرض التصوير الفوتوغرافي.
(2) كما يستخدم السلينيوم في تنصيل الزجاج وفي إضافة اللون الأحمر القرمزي إلى الزجاج الشفاف والغشاوات شبه الزجاجية حيث يستخدم السلينيوم الأحمر في صناعة أواني السيراميك لإعطائها لون زاهي في التزجيج.
(3) يتم تشغيل الآلة الحاسبة بواسطة خلية شمسية مصنوعة من السلينيوم والنيكل.
(4) بالإضافة إلى ذلك يستخدم في صناعة الأحبار في آلات التصوير المكتبية على شكل مسحوق.
(5) يعالج قشرة الرأس لذلك فهو يستخدم في صناعة الشامبو ضد القشرة.
(6) له استخدامات إضافية في المقومات والتجهيزات الإلكترونية.
(7) كمادة مضافة في الفولاذ العديم الصد والخلائط الأخرى.
(8) تستخدم مركبات السلينيوم كمبيد حشري لمقاومة الحشرات التي تهاجم النباتات الزراعية وكذلك في معالجة أمراض جلدية عديدة.
تأثير السيلينيوم على جسم الإنسان
– يمكن أن يدخل السيلينيوم الجسم عن طريق تناول الطعام أو شرب المياه أو تنفس الهواء
– كما يعد الامتصاص المعوي المعدي المصدر الأساسي للسلينيوم المختزن داخل الجسم لدى عموم الناس.
– يتم امتصاصه بنسبة 80% من السلينيوم الموجود ضمن الغذاء والمركبات اللاعضوية.
– لا يعد السلينيوم خطراً صحياً إلا في حال دخول الجسم.
– لا يعد التعرض الخارجي لأشعة جاما مصدر قلق لأن السلينيوم يضمحل عن إطلاق جسيم بيتا بدون اشعاع جاما
– حينما يكون داخل الجسم يبدي السلينيوم خطراً صحياً بسبب جسيمات بيتا التي تتطلق خلال اضمحلاله الإشعاعي ويترافق خطره الأهم بالاحتمالية المتزايدة للإصابة بالسرطان.
– كما يعد السيلينيوم مضاد أكسدة رئيسي يستطيع حماية أغشية الخلايا وبذلك يقلل من خطورة بعض أنواع السرطان وأمراض القلب والأوعية الدموية
– يمكن للتعرض المزمن لمستويات معتدلة منه أن تسبب الإعياء والالتهاب المعدي المعوي وفقدان الشهية المرضي والتنكس الكبدي.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.