البروم Bromine – الخواص الفيزيائية والكيميائية للبروم
محتويات الموضوع
ما هو عنصر البروم Bromine؟
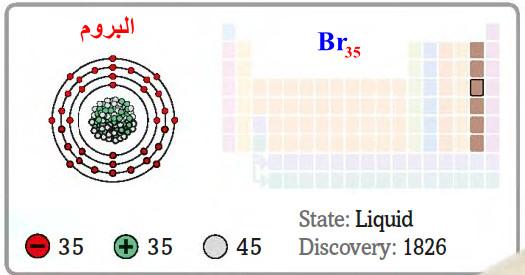
– البروم هو عنصر من عناصر الجدول الدوري: العدد الذري = 35 ، العدد الكتلي = 80
– الرمز الكيميائي لعنصر البروم يرمز له بالرمز: 80Br35
– التوزيع الإلكتروني له: Ar]18 4s2 3d10 4p5]
– البروم لافلز، ينتمي إلى عائلة الهالوجينات المكونة للمجموعة (17) من الجدول الدوري المناصر
– هو سائل أحمر بني، رائحته نفاذة، وله كثافة أكبر من كثافة الماء.
– لا يذوب البروم في الماء إلا بنسبة صغيرة، وهو يكون مع الماء طبقتين، العليا منها هي ماء البروم وتحتوي على نحو 3.6% من البـروم عند 10مo ، والسفلى منها تتكون من البـروم الذي يحتوي على نسبة صغيرة من الماء لا تزيد عن %0.04 فقط.
– يذوب البروم بسهولة في الكلوروفورم وفي الإيثر.
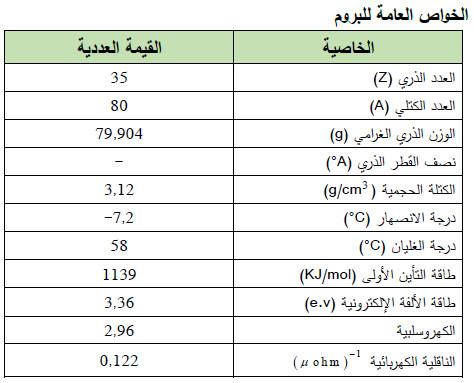
– الجدول التالي يوضح الخواص العامة لعنصر البـروم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Bromine
– في عام 1826، اكتشف الكيميائي الفرنسي أنطوان جيروم بالارد Antoine-Jérôme Balard البروم حيث قام بتسخين مياه البحر من المستنقعات المالحة ، وبعد أن تبخر معظم الماء ، قام بتمرير غاز الكلور عبر ما تبقى. تحول السائل المتبقي إلى اللون البرتقالي والأحمر: كان هذا هو البروم.
– سمي في أول الأمر Muride قبل أن تعطيه أكاديمية العلوم التسمية الحالية.
– اشتق اسمه من الكلمة اليونانية Bromos بمعنى رائحة كريهة نتنة.
– لا يوجد البـروم حراً في الطبيعة وذلك لشدة فعاليته الكيميائية، ولكن توجد مركباته بكميات صغيرة في مياه البحار.
– كما يوجد بكميات متوسطة في الطبقات العليا لرواسب البوتاس على هيئة بروميد البوتاسيوم وبروميد المغنيزيوم.
طرق تحضير البروم Preparation of Bromine
– يحضر البروم مخبرياً بتأثير مؤكسد قوي على محلول حمضي يحوي شوارد البروميد – Br مثلاً:
MnO2 + 2NaBr + 3H2SO4 → Br2 + 2NaHSO4+ 2H2O
– أما صناعياً فيتم تحضير البروم من طريقة أكسدة شوارد البروميد الموجودة في الأملاح المنحلة في مياه المحيطات أو الأملاح الصخرية.
– ونظرا لأن هذه الأملاح تحتوي على كميات عالية من شوارد الكلوريد وكميات ضئيلة من شوارد البروميد لذلك يستعمل الكلور عاملاً مؤكسداً يؤكسد شوارد البروميد وفق التفاعل التالي:
Cl2 + 2Br– → 2Cl– + Br2
– والبروم المتحرر يكون بتركيز منخفض لذا يجرف من المحلول بتيار من الهواء على عدة مراحل حيث يجمع في غرف خاصة تحوي كربونات الصوديوم التي بدورها تمتص البـروم وتفصله عن الهواء:
3Br2 + 3CO32- → 5Br– + BrO3– + 3CO
بتحميض محلول الكربونات تنطلق أبخرة البـروم نتيجة التفاعل:
5Br – + BrO3 + 6H+ → 3Br2 + 3H2O
الخواص الكيميائية لعنصر البروم Chemical properties of Bromine
– يتفاعل البروم مباشرة مع غاز الهيدروجين، كما يتفاعل مع الكبريت والفوسفور ولكنه لا يتفاعل مع الكربون أو الأكسجين أو النتروجين، وهو يتحد بالفلزات مكونا بروميدات تشبه الكلوريدات في خواصها.
(1) التفاعل مع الهيدروجين
– يتكون بروميد الهيدروجين عند إمرار تيار من غاز الهيدروجين في البـروم ثم إمرار الخليط الناتج فوق البلاتين المسخن لدرجة الاحمرار كما بالمعادلة الآتية:
(H2 + Br2 → 2HBr + (2 x 8600 calorie
– يتأكسد بروميد الهيدروجين بسهولة، فهو يتحول في وجود الأكسجين إلى البـروم والماء كما بالمعادلة الآتية:
2HBr + O2 → Br2 + H2O
(2) التفاعل مع الفلزات
– يتفاعل البروم مع بعض الفلزات مباشرة مثل الحديد والقصدير، وغالبا ما يتكون بروميد الفلز ذو التكافؤ الأعلى في هذه التفاعلات مثل بروميد القصدير وبروميد الحديد.
2Fe + 3Br2 → 2FeBr3
Sn + 2Br2 → SnBr4
(3) التفاعل مع القواعد
– يتفاعل البروم مع هيدروكسيد البوتاسيوم على البارد لتكوين بروميد البوتاسيوم وهيبوبروميت البوتاسيوم كما بالمعادلة الآتية:
Br2 + 2KOH → KBr + KBrO + H2O
– يمكن التعبير عن تكوّن برومات البوتاسيوم بتفاعل البروم مع هيدروكسيد البوتاسيوم بمعادلة واحدة كما يلي:
3Br2 + 6KOH → 5KBr + KBrO3 + 3H2O
(4) الخواص المؤكسدة
يمكن للبروم أو محلوله المائي أن يؤكسد H2S إلى الكبريت كما بالمعادلة الآتية:
H2S + Br2→ 2HBr + S
(5) تفاعلات الإضافة والاستبدال
– يستخدم البروم للكشف عن وجود الروابط غير المشبعة في المركبات العضوية، وذلك بإضافة محلوله في الكلوروفورم أو في رابع كلوريد الكربون إلى محلول المادة العضوية في المذيب نفسه، فيختفي لون البـروم.
CH2 = CH2 + Br2 → CH2Br – CH2Br
– يحل البـروم كذلك محل الهيدروجين في بعض المركبات العضوية، ومثال ذلك تفاعله مع البنزين لتكوين البروموبنزين كما بالمعادلة الآتية:
C6H6 + Br2 → C6H5Br + HBr
– يحل البـروم كذلك محل الهيدروجين في كبريتيد الهيدروجين كما بالمعادلة الآتية:
H2S + Br2→ 2HBr
– كما يحل محل اليود في مركباته كما بالمعادلة الآتية:
2KI + Br2 → 2KBr +I2
استخدامات البروم Uses of Bromine
(1) يستخدم ماء البروم للكشف عن الروابط الغير مشبعة في المركبات العضوية.
(2) استخدام ملح بروميد البوتاسيوم في أواخر القرن التاسع عشر لمساعدة المرضى على النوم.
(3) تم استخدام البروم كسلاح في الحرب العالمية الأولى.
(4) إنه يعمل بشكل أفضل من الكلور الموجود في أحواض الاستحمام الساخنة حيث يتسرب الكلور إلى الهواء بسهولة من الماء الدافئ. يمكن تنظيم تركيز البـروم في حمامات السباحة باستخدام أدوات الاختبار الكيميائية Bromine chemical test kit
(5) يمكن استخدام مركبات البـروم في التصوير الفوتوغرافي للأفلام حيث يتم طباعة الصور باستخدام المواد الكيميائية على الصور السلبية Photograph negative
(6) اليوم، يستخدم البروم بشكل أساسي في المواد المقاومة للحريق، مثل بدلات رجال الإطفاء أو المفروشات، لأنه لا يشتعل بسهولة.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.