الزركونيوم Zirconium – الخواص الفيزيائية والكيميائية له
محتويات الموضوع
ما هو عنصر الزركونيوم Zirconium؟
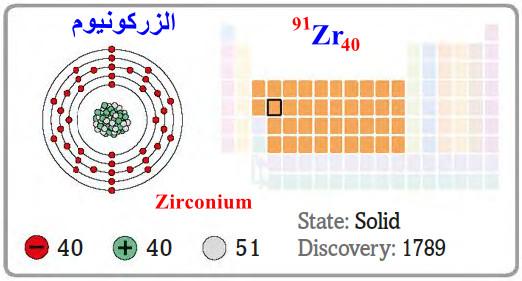
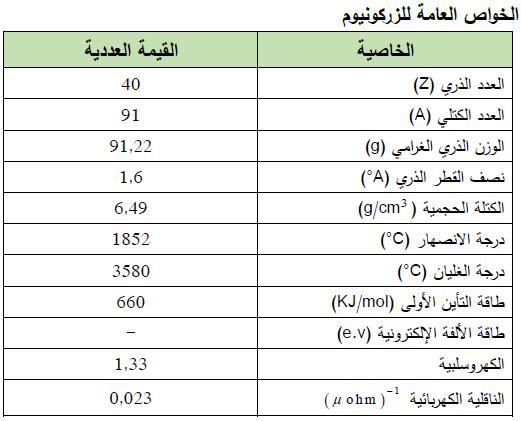
– الزركونيوم Zirconium هو عنصر من عناصر الجدول الدوري: العدد الذري = 40 ، العدد الكتلي = 91
– الرمز الكيميائي لعنصر الزركونيوم يرمز له بالرمز: 91Zr40
– التوزيع الإلكتروني له: Kr]36 5s2, 4d2]
– الزركونيـوم Zirconium معدن براق ذو لون أبيض مائل للرمادي ومقاوم للتآكل.
– عندما يكون الزركونيـوم بشكله المقسم الناعم، فإنه يستطيع أن يشتعل تلقائياً في الهواء، وخاصة في درجات الحرارة العالية.
– هو يمتاز بخواص ميكانيكية ممتازة فهو قابل للسحب والطرق قليل الامتصاص للنيترونات.
– الجدول التالي يوضح الخواص العامة لعنصر الزركونيـوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Zirconium
– كان الكيميائي السويدي جاكوب برزيليوس Jacob Berzelius أول شخص عزل الزركونيـوم النقي في عام 1824.
– ولكن اليوم يستخدم العنصر في الغالب في شكل مركب ثاني أكسيد الزركونيـوم أو الزركونيا zirconia
– الزركونيـوم والزرقون Zircon بمعنى لون الذهب باللغة الفارسية القديمة والعربية نسبة إلى اللون الذهبي للحجر الكريم ZrSiO4.
– كما تشكل مركبات معدن الزركونيـوم 0.025 من القشرة الأرضية.
– بالإضافة إلى ذلك فأنه يوجد بشكل طبيعي في عدد من المعادن، ولكنه لا يظهر بشكل عام في رواسب مركزة.
– إن المعدن المعروف بالزركون (أورثوسيليكات الزركونيـوم)، والذي يوجد في رواسب الطمي في قيعان الجداول أو شواطئ المحيطات أو قيعان البحيرات القديمة، هو المصدر التجاري الوحيد للزركونيوم.
طرق تحضير الزركونيوم Preparation of Zirconium
– يتم تحضيره بمعالجة خاماته بالكربون وغاز الكلور المسخنين لدرجة الاحمرار، إذ نحصل على كلوريد الزركونيـوم الرباعي (ZrCl4) المشوب.
– نختزل كلوريد الزركونيـوم هذا بمعدن الماغنسيوم بعد تنقيته بإحدى الطرق المتبعة في تعدين التيتانيوم.
– فنحصل مثلاً على الزركونيـوم النقي إذا استخدمنا طريقة يوديد الزركونيـوم بعد تفكيكه على سلك مسخن (طريقة فان اركل):
ZrI4 → Zr + 2I2
الخواص الكيميائية لعنصر الزركونيوم Chemical properties of Zirconium
هذا العنصر خامل كيميائياً عند الدرجة العادية من الحرارة ونشيط عند الدرجات المرتفعة، لذا يتفاعل مع المواد التالية عند الدرجات المرتفعة من الحرارة.
(1) التفاعل مع الأكسجين
– يتفاعل الزركونيوم مع الأكسجين بالتسخين ويتشكل ZrO2 كما بالمعادلة الآتية:
Zr + O2 → ZrO2
(2) التفاعل مع الماء
– كما يتفاعل الزركونيوم مع الماء فيتشكل أكسيده وينطلق غاز الهيدروجين كما بالمعادلة الآتية:
Zr + 2H2O → ZrO2 + 2H2
(3) التفاعل مع الهالوجينات
– يتفاعل الزركونيوم مع الهالوجينات، فيتشكل هاليد الزركونيـوم كما بالمعادلة الآتية:
Zr + 2X2 → ZrX4
(4) التفاعل مع أشباه المعادن
– يتحد الزركونيوم مع أشباه الفلزات: B, C , N, S عند الدرجة 1000مo وذلك كما بالمعادلات الآتية:
Zr + 2Si → ZrSi2
Zr + N → ZrN
C + Zr → ZrC
Zr + B → ZrB
(5) التفاعل مع الماء الأكسجيني
– يتفاعل الزركونيوم مع الماء الأكسجيني مشكلاً فوق الأكسيد كما بالمعادلة الآتية:
2Zr + H2O2 → Zr2O2 + 2–OH
– أملاح الشوارد Zr+4 عديمة اللون وهي أكثر ثباتاً في المحاليل وعند تحللها مائياً نحصل على:
+Zr4+ + H2O → ZrO2+ + 2H
استخدامات الزركونيوم Uses of Zirconium
(1) الزركونيوم مقاوم جداً للتآكل الذي يحدث بوجود العديد من الأحماض والقلويات الشائعة وكذلك ماء البحر، ولهذا السبب يستخدم بشكل مكثف في الصناعة الكيميائية حيث تستخدم العوامل الحاتة.
(2) يستخدم الزركونيوم كذلك في أنابيب التخلية، في الفولاذ وفي أجهزة العمليات الجراحة ومصابيح التصوير الوامضة وكبسولات التفجير وشعيرات المصابيح.
(3) كما يستخدم في مستحضرات اللبلاب السام على شكل كربونات ونشير إلى أن الزركون المعدني يتصف بقرينة انكسار مرتفعة.
(4) يشكل مسحوق الزركونيا أيضًا بلورات زركونيا متلألئة تشبه الماس لذلك تستخدم كمادة حجر كريم وفي صنع الخواتم.
(5) أما أكسيد الزركونيوم غير النقي فإنه يستخدم في بوتقات المخابر التي تستطيع مقاومة الصدمة الحرارية، وكذلك تبطين أفران التعدين،
(6) كما يستخدم في صناعة الزجاج والسيراميك كمادة مقاومة.
(7) هذا ويملك الزركونيوم مقطعاً عرضياً خفيض الامتصاص للنترونات، مما يجعله مادة مثالية للاستخدام في تطبيقات المفاعلات النووية.
(8) بالإضافة إلى ذلك يتم تسخين مسحوق الزركونيا لإنتاج السيراميك الصلب الشبيه بالزجاج، والذي يستخدم لصنع تيجان الأسنان وسكاكين السيراميك الحادة.
تأثير الزركونيوم على جسم الإنسان
– يمكن للزركونيوم أن يدخل الجسم عن طريق تناول الطعام أو شرب المياه أو استنشاق الهواء.
– يعد الامتصاص المعوي من الطعام والمياه المصدر الأساسي للزركونيوم المتواضع داخلياً لدى عامة الناس.
– يتوضع حوالي نصف الزركونيـوم – الذي يصل إلى الدم – في الهيكل العظمي حيث يتميز بعمر نصف بيولوجي يساوي 8000 يوم.
– أما النصف الأخر فيتوضع في جميع الأعضاء المتبقية أنسجة.
– وبما أن الزركونيوم لا يؤلف مكونا أساسياً من المكونات المعدنية للعظام، فإن الكمية المتواضعة منه في الهيكل العظمي يفترض أن تبقى على السطوح العظمية دون أن يتم امتصاصها إلى داخل كتلة العظام.
– لا يشكل الزركونيوم خطراً على الصحة إلا في حال دخوله داخل وكذلك في الجسم.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.