التربيوم Terbium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر التربيوم Terbium؟
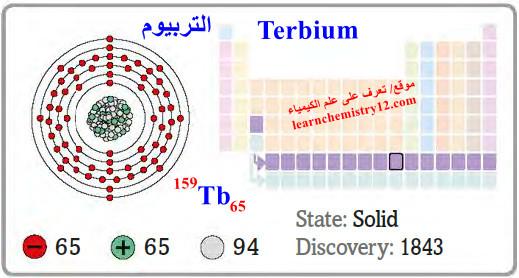
– التربيوم Terbium هو عنصر من عناصر الجدول الدوري: العدد الذري = 65 ، العدد الكتلي = 159
– الرمز الكيميائي لعنصر التربيوم يرمز له بالرمز: 159Tb65
– التوزيع الإلكتروني له: Xe]54 6s2 4f9]
– التربيوم معدن فضي اللون (رمادي)، مرن وناعم لدرجة أنه بالإمكان قطعه بسكين.
– وهو مستقر بشكل معقول في الهواء وهو معدن نادر جداً.
– لم يتم عزل العنصر نفسه إلا في الأونة الأخيرة.
– الجدول التالي يوضح الخواص العامة لعنصر التربيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Terbium
– اكتشف التربيوم عام 1843م بواسطة الكيميائي السويدي كارل جوستان موساندر والذي اعتبره من الشوائب العالقة في أكسيد الإرتيم.
– سمي بهذا الاسم نسبة لقرية إيرتيم Ytterby في السويد.
– لا يتواجد التربيوم إطلاقاً منفرداً في الطبيعة، ولكنه يوجد في العديد من المعادن بما فيه السيريت، الجادولينايت ،والمونازيت، وتحتوي تلك المعادن على نسبة %0.03 من التربيوم.
تحضير التربيوم Preparation of Terbium
– كباقي اللانثانيدات يتم استحصاله بتقنية التبادل الأيوني المطورة من الأتربة الأرضية المتواجدة فيها.
مركبات التربيوم Terbium Compound
(1) ثلاثي كلوريد التربيوم TbC13
– هو مركب كيميائي صلب كثيراً ما يسبب احتقان القزحية (احمرارها).
– الشكل التالي يوضح بنية هذا المركب كما يلي:
(2) ثنائي سيليسيد التربيوم TbSi2
– هو مركب كيميائي صلب لونه رمادي، يتكون من التربيوم والسيليكون.
– له عدة تطبيقات في أجهزة الكشف عن الأشعة تحت الحمراء والأجهزة الحرارية.
– الشكل التالي يوضح مظهر هذا المركب كما يلي:
(3) هبتا أكسيد رباعي التربيوم Tb4O7
– يتم تحضيره عن طريق تسخين الأوكسالات المعدنية وغالباً ما يتم تحضيره عن طريق احتراق الأوكسالات تحت درجة حرارة °100C أو الكبريتات في الهواء تحت درجة حرارة أعلى.
– ويتم استخدام هذا المركب في تحضير أكاسيد التربيـوم.
– عند تسخينه تحت درجة حرارة عالية يفقد الأكسجين.
– كما يتفاعل مع الأحماض المركزة الساخنة لإنتاج أملاح التربيـوم فعلى سبيل المثال: تفاعله مع حمض الكبريتيك يعطي كبريتات التربيـوم وتفاعله مع حمض الهيدروكلوريك يكون محلول من كلوريد التربيـوم وعنصر الكلور وذلك تحت درجة حرارة الغرفة.
(4) ثلاثي أكسيد التربيوم Tb2O3
– يمكن تحضيره بإختزال هبتا أكسيد رباعي التربيـوم Tb4O7 في الهيدروجين تحت درجة حرارة °1300C لمدة 24 ساعة.
– الشكل التالي يوضح بنية هذا المركب كما يلي:
– هو عبارة عن أكسيد قاعدي ينحل بسهولة في الأحماض الضعيفة فيصبح عديم اللون ويشكل لنا أملاح التربيـوم كما بالتفاعل التالي:
Tb2O3 + 6H+ → 2Tb3+ + 3H2O
– كما أنه عند مزجه مع الكالسيوم يصبح شبه ناقل.
(5) ثاني أكسيد التربيوم TbO2
– ينتج من تفاعل هبتا أكسيد رباعي التربيـوم مع الأكسجين في وجود حمض كلور الماء وحمض الخل لمدة 30 دقيقة كما بالتفاعل التالي:
Tb4O7 + 6HCl → 2TbO2 + 2TbCl3 + 3H2O
– الشكل التالي يوضح بنية هذا المركب كما يلي:
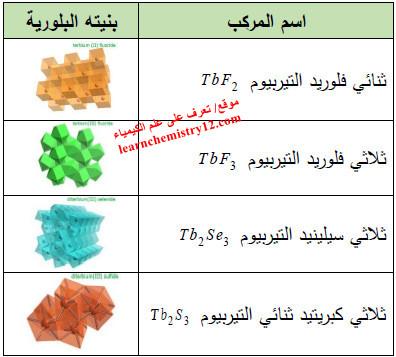
(6) مركبات أخرى
– الجدول التالي يوضح أشهر مركبات التربيـوم الأخري التي لم يتم ذكرها كما يلي:
الخواص الكيميائية لعنصر التربيوم Chemical properties of Terbium
(1) التفاعل مع الهواء
– التربيوم المعدني يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثلاثي أكسيد التربيـوم ذو الصيغة Tb4O7 كما بالتفاعل التالي:
8Tb + 7O2 → 2Tb4O7
(2) التفاعل مع الماء
– معدن التربيوم الفضي اللون يتميز بكهروإيجابية عالية فيتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد التربيـوم Tb(OH)3 وغاز الهيدروجين H2 كما بالتفاعل التالي:
2Tb + 6H2O → 2Tb(OH)3 + 3H2
(3) التفاعل مع الهالوجينات
– التربيوم المعدني يتفاعل مع كل الهالوجينات لتشكيل هاليدات التربيـوم الثلاثية، ومنه يتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي: ثلاثي فلوريد التربيـوم، ثلاثي كلوريد التربيـوم، ثلاثي بروميد التربيـوم، ثلاثي يوديد التربيـوم، كما بالتفاعلات التالية:
(أبيض) (s)2Tb(s) + 3F2(g) → 2TbF3
(أبيض) (s)2Tb(s) + 3Cl2(g) → 2TbCl3
– أما في حالتي البروم واليوم يكون التفاعل كما يلي:
(أبيض) (s)2Tb(s) + 3Br2(g) → 2TbBr3
(أبيض) (s)2Tb(s) + 3I2(g) → 2TbI3
(4) التفاعل مع الأحماض
– معدن التربيوم يذوب بسهولة في حمض الكبريتيك المخفف لتشكيل محاليل ذات اللون الوردي الشاحب جداً تحتوي على أيون التربيـوم الثلاثي كما بالتفاعل التالي:
2Tb(s) + 3H2SO4(aq) → 2Tb3+(aq) + 3SO42- (aq) + 3H2(g)
استخدامات التربيوم Uses of Terbium
(1) التربيوم يستخدم على نطاق واسع مع الفوسفورات الذي يستخدم في أنابيب التلفزيون وكذلك في شاشات الأشعة السينية ومصابيح الفلورسنت.
(2) يستخدم كمكون في صناعة سبائك من مختلف المعادن.
(3) كما يستعمل في صنع خلايا الوقود.
(4) يستخدم كعامل منشط في عدد من المواد مثل الكالسيوم، التنغستات، فلوريد الكالسيوم وموليبدات السترونتيوم، وتستخدم هذه المواد في الأجهزة الإلكترونية المختلفة.
(5) تتم إضافة التربيوم النقي إلى معادن أخرى لصنع مغناطيس قوي يستخدم في أجهزة إنتاج الصوت، مثل ™SoundBug.
(6) علاوة على ذلك تستخدم مركباتها لتبطين مصابيح الزئبق.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017