الكيمياء الكهربية تدرس التفاعلات الكيميائية المرتبطة بالكهرباء، مثل التفاعلات في الخلايا الكهروكيميائية. تشمل البطاريات، الأقطاب، والتفاعلات الأيونية، وتُستخدم في توليد الطاقة وتحليل المركبات الكيميائية.
الكيمياء الكهربية
-
تحميل كتاب المصطلحات الكيميائية pdf
استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام. نقدم لكم في هذا الموضوع كتاب غاية في…
أكمل القراءة » -
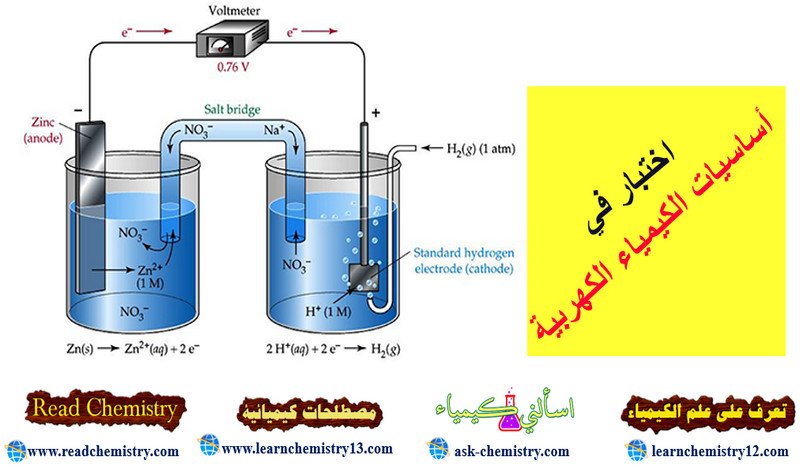
اختبار في أساسيات الكيمياء الكهربية
اختبار في أساسيات الكيمياء الكهربية في هذا الموضوع نقدم لك أختبار في أساسيات الكيمياء الكهربية. وهو أختبار بسيط لقياس مدى…
أكمل القراءة » -
مسائل محلولة على جھد الخلیة الجلفانية – الجزء الأول
في هذا الموضوع سوف نقوم بعرض (10) مسائل وإجاباتها على جهد الخلية الجلفانية ملاحظات هامة على جهد الخلية قبل البدء…
أكمل القراءة » -
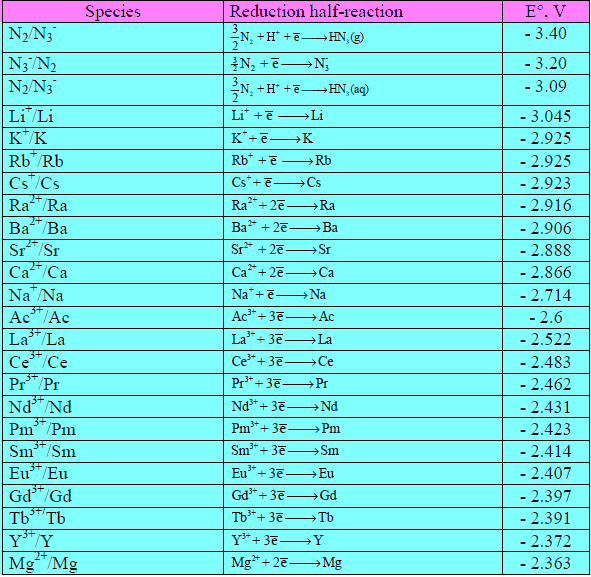
السلسلة الكهروكيميائية Electrochemical Series
السلسلة الكهروكيميائية Electrochemical Series – السلسلة الكهروكيميائية هو ترتيب للمواد وفق نشاطها الكيميائي بالاعتماد على جهود الاختزال المعيارية. – رتبت…
أكمل القراءة » -
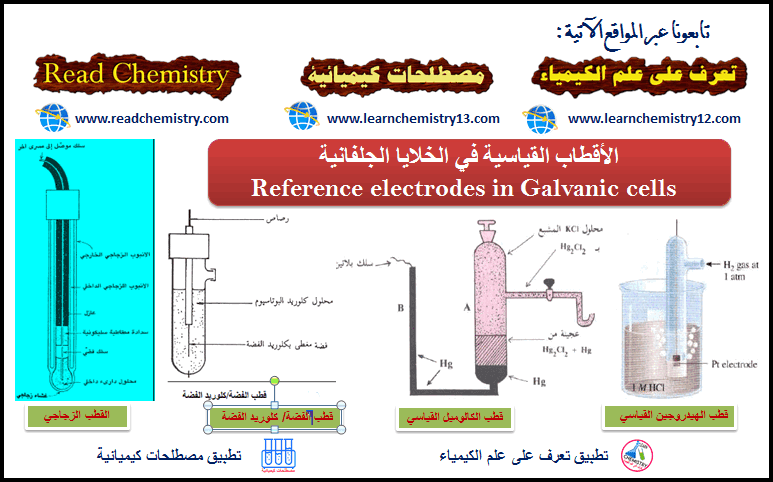
الأقطاب القياسية في الخلايا الجلفانية Reference electrodes in Galvanic cells
قطب الهيدروجين القياسي eStandard Hydrogen electrod اتفق أو اصطلح على اتخاذ ما يعرف بقطب الهيدروجين القياسي القياسي ويرمز له بالرمز…
أكمل القراءة » -
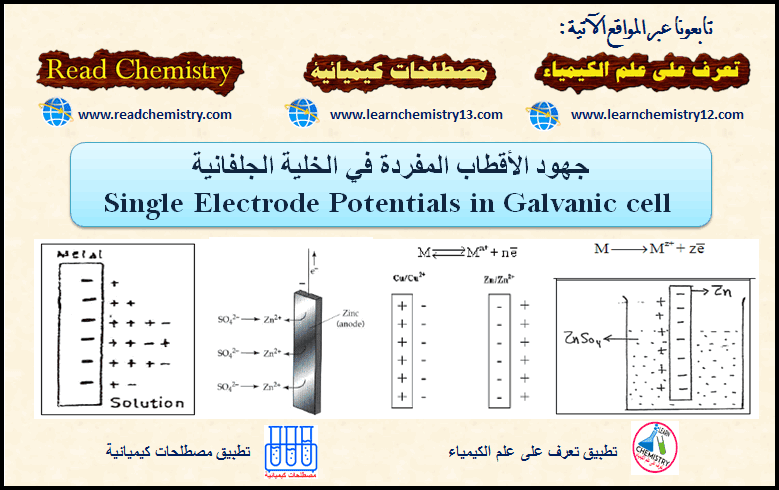
جهود الأقطاب المفردة Single Electrode في الخلية الجلفانية
– من المعروف أن التیار الكھربي لا ینتقل من نقطة الى أخرى إلا إذا كان ھناك فرق جھد بین نقطتین.…
أكمل القراءة » -
حساب جهد الخلية (القوة الدافعة الكهربائية) Calculation of EMF
حساب جهد الخلية (القوة الدافعة الكهربائية (EMF – يعرف الجهد الكهربائي بأنه القدرة على اكتساب شحنة موجبة ووحدته قياسه هى…
أكمل القراءة » -
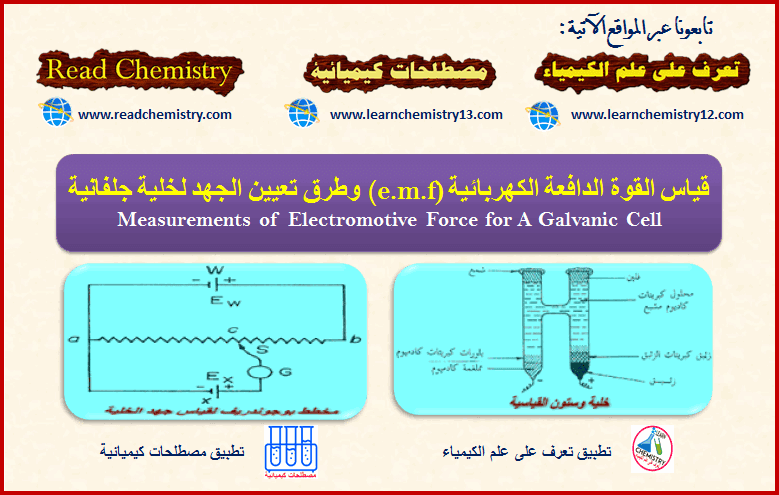
قياس القوة الدافعة الكهربائية (e.m.f) وطرق تعيين جهد الخلية
أولاً/ قياس القوة الدافعة الكهربية للخلايا الجلفانية Measurements of Electromotive Force for A Galvanic Cell – مرور التيار الكهربي يعنى…
أكمل القراءة » -
علامات ( تعليم أو ترميز) الخلايا الكهروكيميائية Cell Representation
للتبسيط فأننا نلجأ أحياناً إلى طريقة الترميز في تصميم الخلايا الكهروكيميائية بدلاً من التصميم الهندسي الذي يأخذ وقتاً وجهداً.…
أكمل القراءة » -
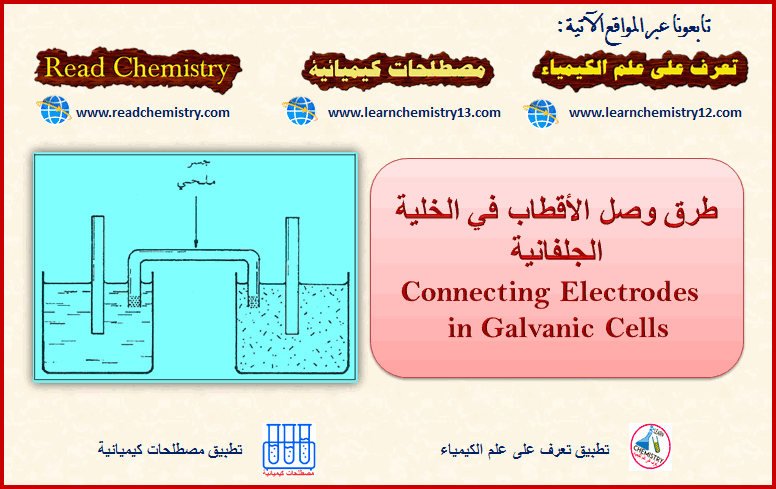
وصل الأقطاب في الخلية الجلفانية Galvanic Cells
وصل الأقطاب في الخلية الجلفانية – لما كان القطب (الأقطاب) يتكون من قضيب لمادة مغمورة في محلول. فإن وصل قطب…
أكمل القراءة » -
معلومات هامة يجب عليك معرفتها قبل البدء في دراسة الكيمياء الكهربية
(1) تعريف الكيمياء الكهربية Definition of Electrochemistry – الكيمياء الكهربية هي ذلك الفرع من الكيمياء الفيزيائية الذي يهتم بدراسة التحولات…
أكمل القراءة » -
أنواع تفاعلات الأكسدة والأختزال Redox Reactions
أنواع تفاعلات الأكسدة والأختزال يمكن تقسيم تفاعلات الأكسدة والأختزال كما يلي: (1) تفاعلات الاتحاد المباشر Combination reactions (2) تفاعلات الانحلال…
أكمل القراءة » -
تحميل كتاب الكيمياء الحركية والكهربية تأليف/ محمد مجدي واصل
– إستكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام. نقدم لكم اليوم كتاب غاية في الروعة…
أكمل القراءة » -
تحميل كتاب الحركيات والكيمياء الكهربائية تأليف/ عبد الحميد الدباغ
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية…
أكمل القراءة » -
وزن معادلات الأكسدة والاختزال Redox equations
وزن معادلات الأكسدة والاختزال تتم عملية وزن معادلات الأكسدة والاختزال بطريقتين كما يلي: (1) طريقة الأيون – إلكترون (طريقة نصف…
أكمل القراءة » -
كيفية تمييز تفاعلات الأكسدة والاختزال عن غيرها من التفاعلات
– في هذا الموضوع سيتم مناقشة كيفية تمييز تفاعلات الأكسدة والاختزال Redox reactions عن غيرها من التفاعلات مع ذكر الأمثلة…
أكمل القراءة » -
خلية دانيال الجلفانية Daniel cell
– في هذا الموضوع سيتم مناقشة تركيب خلية دانيال الجلفانية Daniel cell ومكوناتها وكذلك التفاعلات الحادثة بداخلها. تعريف الخلايا الجلفانية…
أكمل القراءة » -
تحميل كتاب أسس الكيمياء الكهربية للدكتور/ محمد مجدي واصل
– استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بشرحها للأعضاء الكرام. نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة » -
عدد التأكسد – أعداد الأكسدة Oxidation Number
تعريف عدد التأكسد – عدد التأكسد (عدد الأكسدة) Oxidation Number هو عدد الإلكترونات التى يمكن أن يفقدها أو تكتسبها أو…
أكمل القراءة » -
كتاب 3000 مسألة محلولة في الكيمياء pdf – سلسلة المسائل المحلولة شوم
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب رائع…
أكمل القراءة »
- 1
- 2