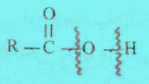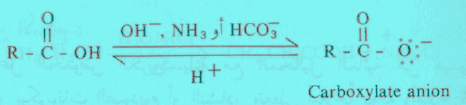تكوين الأملاح في الأحماض الكربوكسيلية وتفاعلاتها
في هذا الموضوع سوف نتكلم عن كيفية تكوين الأملاح للأحماض الكربوكسيلية
تفاعلات الأحماض الكربوكسيلية
– من النظر إلى المجموعة الفعالة المميزة للأحماض الكربوكسيلية وهي مجموعة الكربوكسيل (COOH)، فإن هناك احتمالين لكسر الروابط في هذه المجموعة.
– وعليه فإن تفاعلات الأحماض الكربوكسيلية التي تتميز بها هي:
(1) تفاعلات تنفصم فيها الرابطة بين الهيدروجين والأكسجين.
(2) وتفاعلات تنفصم فيها الرابطة بين الأكسجين وذرة كربون مجموعة الكربونيل.
(3) بالإضافة إلى أن هناك تفاعلات أخرى معينة للحموض الكربوكسيلية لا تنطبق ونوعي التفاعلات المذكورة أعلاه.
– وسندرس في هذا الموضوع كيفية تكوين الأملاح للأحماض الكربوكسيلية، على أن نستكمل باقي تفاعلات الأحماض الكربوكسيلية في الموضوعات القادمة.
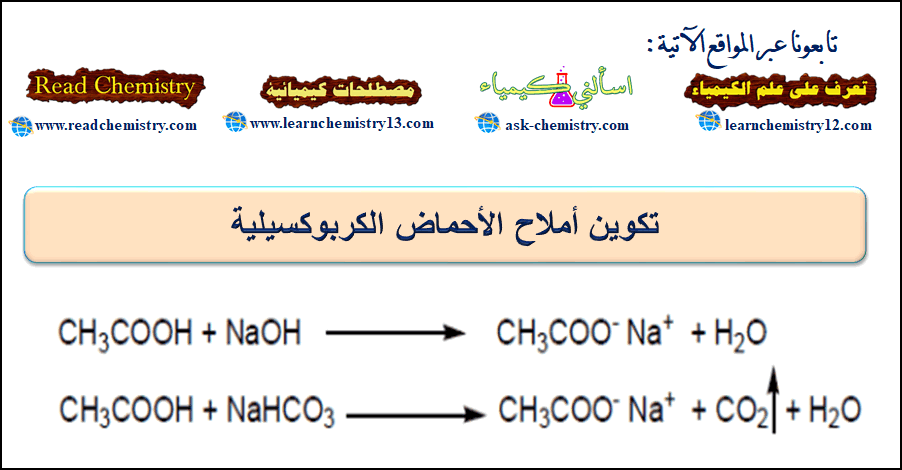
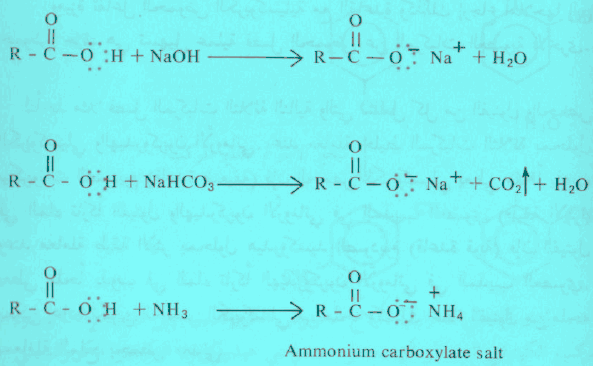
تكوين الأملاح للأحماض الكربوكسيلية
– تتفاعل الحموض الكربوكسيلية مع المحاليل المائية من هيدروكسيد الصوديوم أو بيكربونات الصوديوم أو النشادر وتعطي أملاحاً ذوابة (أملاح المعادن الثقيلة في العادة غير ذوابة).
– ويُعتمد على هذا التفاعل للتمييز بين الحموض الكربوكسيلية التي لا تذوب في الماء من جهة وبين الكحولات والفينولات التي لا تذوب في الماء من جهة أخرى. إذ تذوب الحموض الكربوكسيلية في المحاليل المائية لكل من هيدروكسيد الصوديوم والبيكربونات والنشادر.
– أما الخاصية الحمضية في الفينولات فضعيفة لدرجة أن ليس لها القدرة على أن تحرر CO2 من البيكربونات. وذلك على الرغم من أنها ذوابة في القاعدة القوية مثل هيدروكسيد الصوديوم. أما الكحولات غير الذوابة في الماء فلا تذوب في المحاليل القاعدية القوية منها أو الضعيفة.
– هذا ويمكن إرجاع أملاح الحموض الكربوكسيلية إلى الحموض الحرة عند معادلتها بمحاليل الحموض المعدنية.
– وميزة تفاعل الحموض الكربوكسيلية مع القاعدة وكذلك إرجاع أملاحها إلى حموض حرة، هي تسهيل عملية فصل الحموض عن المركبات العضوية الأخرى.
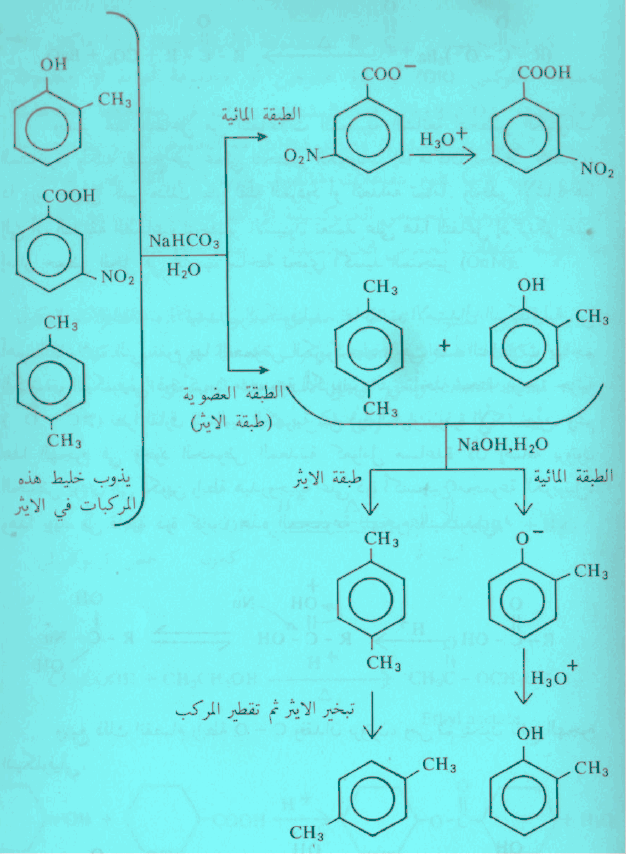
– لنأخذ مثلاً فصل المركبات الثلاثة التالية والتي تشمل كل من الفينول والحمض الكربوكسيلي والهيدروكربون الأروماتي:
عند معاملة خليط المركبات الثلاثة بمحلول بيكربونات الصوديوم (قاعدة ضعيفة) فإن الحمض الكربوكسيلي يعطى ملحاً يذوب في الماء تاركاً الفينول والهيدروكربون الأروماتي في المذيب العضوي (طبقة الإيثر).
وعند معاملة طبقة الأيثر بمحلول هيدروكسيد الصوديوم (قاعدة قوية) فإن الفينول يعطي ملحاً يذوب في الماء تاركاً الهيدروكربون الأروماتي في المذيب العضوي.
يمكن إعادة تكوين الحمض الكربوكسيلي من ملحه وكذلك اعادة الفينول من ملحه بمعاملة الملح بحمض معدني.
التحلل الحراري لأملاح الأحماض الكربوكسيلية
يؤدى التحلل الحراري لأملاح الحموض الكربوكسيلية إلى فقدان CO2 ونشوء المركب الكيتوني المتناظر أي يحمل مجموعتي هيدروكربون الحمض الكربوكسيلي المستخدم.
– يعتبر هذا التفاعل من التفاعلات المخبرية الشائعة لتحضير الكيتونات المتناظرة. ولكنه يصبح غير عملي لتحضير الكيتونات إذا ما كان الحمض العضوي ذا وزن جزيئي كبير وذلك نظراً لقلة المردود أو انعدامه تماماً.
وتجدر الإشارة هنا إلى أن الطريقة الصناعية لتحضير الأسيتون تعتمد على هذا التفاعل إذ ترتكز على إمرار حمض الخل في أنابيب ساخنة تحوي أكسيد المنجنيز (MnO).
مثال: التحلل الحراري لفورمات الكالسيوم
– عند التسخين الجاف لفورمات الكالسيوم ينتج الفورمالدهيد وكربونات الكالسيوم طبقاُ للمعادلة التالية:
– أما عند تسخين أسيتات الكالسيوم نحصل على الأسيتون (كيتون)
– وعند تسخين خليط من فورمات الكالسيوم وأسيتات الكالسيوم نحصل على الفورمالدهيد والأسيتون والأسيتالدهيد.