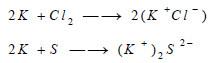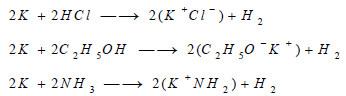معلومات هامة جداً عن عنصر البوتاسيوم Potassium
ما هو عنصر البوتاسيوم Potassium؟
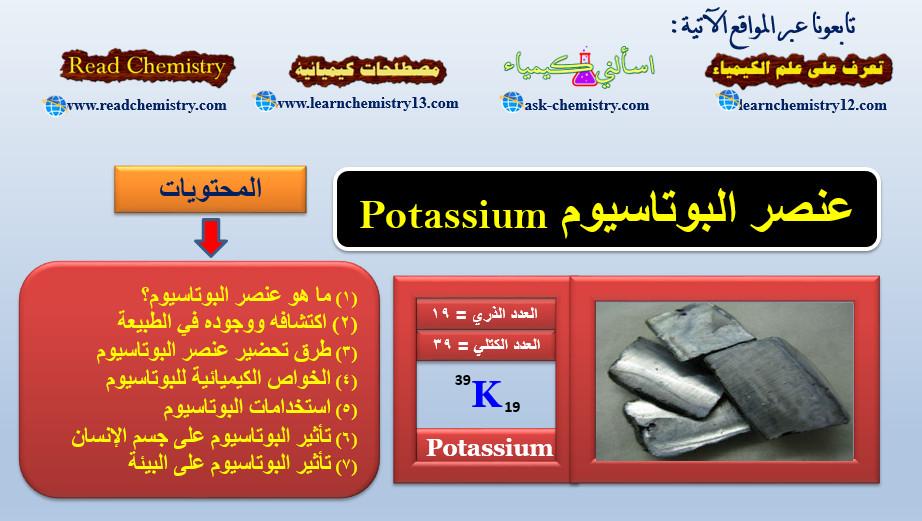
– هو عنصر من عناصر الجدول الدوري: العدد الذري = 19، العدد الكتلي = 39
– التوزيع الإلكتروني لعنصر له: 1S2 , 2S2 2P6 , 3S2 3P6 , 4S1
– عبارة عن معدن ذي مظهر فضي، طري يمكن قطعه بالسكين.
– ذو كثافة منخفضة وناقليته الحرارية والكهربائية عالية.
– يحتوي هذا العنصر في طبقته الخارجية على الكترون واحد في المدار (4S) يمكن أن يفقده بسهولة ليعطي أيون موجب.
– تتميز مركبات هذا العنصـر بكونها بلورية وأيونية ودرجات انصهارها وغليانها عالية جداً.
– وتتميز مركباته البسيطة أيضاً بأنها غير ملونة إلا إذا كان الأيون السالب المرتبط معه ملون مثل البرمنجنات والكرومات ويعود ذلك إلى أن أيون البوتاسيوم غير ملون.
اكتشافه ووجوده في الطبيعة Discovery of Potassium
– اكُتشف عام 1807م من قبل (ديفي Davy) في بريطانيا، اشتق اسمه من العربية قلي بمعنى رماد، ويقال أيضـا من اللاتينية Kalium إشارة إلى كربونات البوتاسيــوم التي تتواجد بشكل صلب في الرماد.
– لشدة فعالية هذا العنصر لا يوجد بشكل حر في الطبيعة، إلا أن مركباته واسعة الانتشار.
– كما يشكل نسبة عالية من وزن القشرة الأرضية (حوالي 2.59%).
– ومن أهم خاماته: الكلوريد والكارناليت KCl . MgCl2 . 6H2O والملخ الصخري KNO3 وبشكل كبريتات مضاعفة للبوتاسيــوم.
– كما أن ماء البحر يحتوي على 0,04% من البوتاسيوم بشكل أملاح منحلة
تحضير البوتاسيوم Preparation of Potassium
إن الطريقة المتبعة تجارياً لتحضير معدن البوتاسيوم تتضمن اختزال مصهور كلوريد البوتاسيــوم بمعدن الصوديوم عند الدرجة 850°م. فيحدث التفاعل المتوازن كما في المعادلة التالية:
بالرغم من أن التفاعل نحو اليسار ممكن ثرموديناميكياً فإن تصاعد بخار البوتاسيوم يؤدي إلى حدوث التفاعل نحو اليمين. يكثف بخار البوتاسيوم وتعاد تنقيته بالتقطير المجزأ فينتج بوتاسيوم بنقاوة عالية 99.99%
الخواص الكيميائية للبوتاسيوم Chemical properties of Potassium
(1) التفاعل مع الأكسجين Reaction between potassium and Oxygen
يتفاعل مع الأكسجين مشكلاً مزيج من الأكاسيد KO2 , K2O2 , K2O ويمكن أن تتفاعل جميع هذه الأكاسيد الماء مع الماء لتعطي هيدروكسيد البوتاسيــوم كما يلي :
(2) التفاعل مع الماء Reaction between potassium and H2O
يتحد مع الماء بشدة مشكلاً هيدروكسيد البوتاسيــوم، وينطلق غاز الهيدروجين كما يلي:-
(3) التفاعل مع أشباه المعادن
يتفاعل مع اللامعادن، ويعطي مركبات تتمتع بالصفـات الأيونية.
- مع الهالوجينات تتشكل مركبات الهاليدات.
- ومع الكبريت يعطي الكبريتيدات.
- ومع الفوســـور الفوســـــفيدات.
ويمكن كتابة المعادلات كما بالشكل التالي:
(4) التفاعلات الأخرى
يمكن أن يتفاعل مع الأحماض والكحول الإيثيلي وغاز النشادر بوجود وسيط وحرارة، مطلقاً غاز الهيدروجين ومشكلاً كلوريد البوتاسيوم أو ايثيلات أو أميد البوتاسيــوم.
استخدامات البوتاسيوم Uses of Potassium
(1) يعتبر من العوامل المختزلة القوية لذلك يستعمل في الحصـول على بعض المعادن ومركباتها.
(2) يستعمل مصـهور مزيج من الصـوديـــــــوم والبوتاسيــوم في عملية التبديد الحراري في المفاعلات النووية.
(3) يستخدم في صناعة الأسمدة مع النيتروجين والفوسفور.
(4) يكون الشكل المعدني له طرياً لدرجة أنه يمكن قطعه بالسكين، ويستخدم في الخلايا الكهروضوئية.
(5) يُعد من أكثر المعادن فعالية في الطبيعة، ويشكل عدداً من المركبات التي تتمتع باستخدامات تجارية عديدة.
(6) يستخدم بروميد البوتاسيوم الصـلب الأبيض في التصـوير الضوئي والحفر والطباعة الحجرية.
(7) تستخدم كرومات البوتاسيوم البلورية الصفراء، كعاملي أكسدة قويين، في أعواد الكبريت والألعاب النارية، وتستخدمان أيضـا لصباغة الأقمشة ودباغة الجلود.
(8) تستعمل كربونات البوتاسيوم في صناعة الصابون والزجاج والمركبات الكيميائية.
تأثير البوتاسيوم على جسم الإنسان
– يمكن أن يدخل إلى الجسم عن طريق ماء الشرب والطعام وتنفس الهواء.
– تتطلب استمرارية العمليات البيولوجية عند الإنسان وجـود البوتاسيوم، وبامتصاص معظمه امتصاصاً تاماً تقريباً بعد تناول الطعام ينتقل بسرعة من القناة الهضمية إلى تيار الدم، ثم يتوزع في جميع الأنسجة والأعضاء.
– يمكن أن يبدي مخاطر صحية خارجية وداخلية على السواء، حيث إنه يسبب داخل الجسم خطراً صحياً ناجماً عن الجسيمات بيتا وأشعة جاما.
– يترافق الخطر الصحي للبوتاسيوم بتدمير الخلايا التي يسببها الإشعاع المؤين الناجم عن التفكك الإشعاعي، إضافة إلى الإمكانية المحتملة لتحريض سرطاني لاحق.
تأثير البوتاسيوم على البيئة
– يرتبط في الدرجة الأولى بالتربة.
– يكون تركيزه في جسيمات التربة الرملية أكبر بحوالي 15 مرة من تركيزه في المياه البينية. ويرتبط بقوة أكبر التربة الطينية.
– باجتماعه مع النيتروجين والفوسفور يعد السماد الأساسي للتربة.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.