الجرمانيوم Germanium – الخواص الفيزيائية والكيميائية له
محتويات الموضوع
ما هو عنصر الجرمانيوم Germanium؟
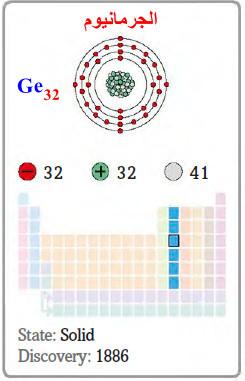
– الجرمانيوم هو عنصر من عناصر الجدول الدوري: العدد الذري = 32 ، العدد الكتلي = 73
– الرمز الكيميائي لعنصر الجرمانيوم يرمز له بالرمز: 73Ge32
– التوزيع الإلكتروني له: Ar]18 4s2 3d10 4p2]
– كما يعتبر الجرمانيـوم شبه معدن رمادي اللون وضعيف الناقلية الكهربائية ويمتاز ببنية بلورية مشابهة لبنية الماس.
– يكون الجرمانيوم النقي في الدرجات المرتفعة من الحرارة نصف ناقل داخلي بسبب وجود الإلكترونات في عصابة التوصيل.
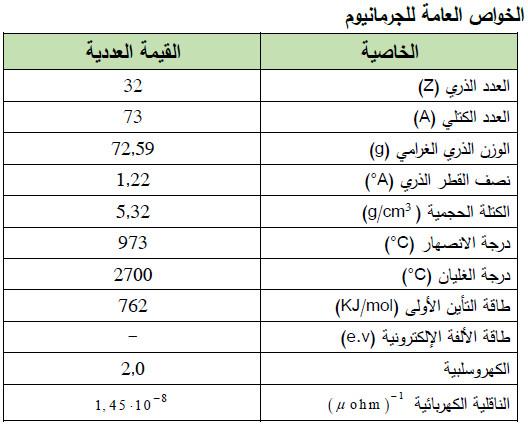
– الجدول التالي يوضح الخواص العامة لعنصر الجرمانيـوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Germanium
– اكتشف الجرمانيوم عام 1886م من قبل (وينكلر Winkler) بتتبعه لتنبؤات ماندليف.
– اشتق اسمه من اللاتينية Germania بمعنى ألمانيا وهو اسم البلد الذي اكتشف فيه.
– كما يعتبر هذا العنصر من العناصر النادرة في الطبيعة (0.001% من وزن القشرة الأرضية) وبالرغم من ذلك فهو معروف جداً وذلك بسبب أهميته.
– يوجد الجرمانيـوم فى الغلاف الجوي لكوكب المشترى.
– كما ينتشر الجرمانيوم بكميات قليلة جداً في كثير من أصقاع العالم ومعظم خامات الزنك والزرنيخ والقصدير والرصاص والنحاس تحوي بعضه، إلا أن أهم خاماته هي:
الأرجيروديت argyrodite ومنها استخرجه العالم (وينكلر) ورمزه الكيميائي: Ag8GeS6
والكانيفيلديت canfieldite ورمزه الكيميائي: Ag8Sn , Ge)S6)
والجرمانيت germanite ورمزه الكيميائي: Cu5 (Cu , Fe)6 As Ge S12 وهو أهمها.
طرق تحضير الجرمانيوم Preparation of Germanium
– يحضر الجرمانيوم من التسخين الشديد لخاماته مع حمض كلور الماء فيتشكل GeCl4 الذي يعامل بالماء فيتشكل GeO2 الذي يُفصل ويختزل بالكربون أو الهيدروجين:
GeCl4 + 2H2O → GeO2 + 4HCl
GeO2 + 2H2 → 2H2O + Ge
الخواص الكيميائية للجرمانيوم Chemical properties of Germanium
(1) التفاعل مع الأكسجين
– يتفاعل الجرمانيوم مع الأكسجين في درجات الحرارة العالية 575 مo ويشكل الأكسيد GeO2.
– وهذا الأكسيد يذوب في حمض فلور الماء HF ويمكن أن يتشكل هذا الأكسيد من التحلل المائي لمركب GeCl4 كما بالمعادلة الآتية:
–GeCl4 + 2H2O → GeO2 + 4H+ + 4C1
(2) التفاعل مع الأحماض
– يتأثر الجرمانيـوم بحمض الكبريت المركز الساخن ببطء فوق الدرجة 90 مo ليشكل الأكسيد المميه GeO2.nH2O
– يؤثر حمض الآزوت المركز والساخن بشدة في الجرمانيوم ويتشكل الأكسيد المميه وينطلق NO2 كما بالمعادلة الآتية:
Ge + 4HNO3 → GeO2 + 4NO2 + 2H2O
(3) التفاعل مع القواعد
– يذوب الجرمانيـوم في القواعد المركزة والساخنة ويشكل الجرمانات كما بالمعادلة الآتية:
Ge + 2OH– + 4H2O → Ge (OH)62- + 2H2
(4) التفاعل مع الهالوجينات
– يتفاعل الجرمانيوم بالتسخين مع الهالوجينات ليشكل GeX4 كما بالمعادلة الآتية:
Ge + 2X2 → GeX4
(5) التفاعل مع الكبريت
– يتفاعل الجرمانيوم مع الكبريت عند الدرجة الحمراء ليشكل GeS2 كما بالمعادلة الآتية:
Ge + 2S → GeS2
استخدامات الجرمانيوم Uses of Germanium
(1) الاستخدامات الرئيسية للجرمانيـوم هي استعماله في الألياف البصرية والبصريات والأشعة تحت الحمراء، إضافة إلى الإلكترونيات والكهرباء من الطاقة الشمسية.
(2) يستخدم أكسيد الجرمانيـوم في عدسو الكامبرا لإنحناء الضوء
(3) تصنع منه بعض الرقائق فى الهاتف المحمول
(4) تحتوى بعض السيارات على مستشعر الجرمانيوم الذي يقيس المسافة بين السيارة والعوائق.
(5) كما يستخدم في صناعة الأجهزة شبه الموصلة مثل الصمامات الثنائية، بطاريات الطاقة الشمسية كذلك والترانزستورات.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.