الزنك Zinc – الخواص الفيزيائية والكيميائية للزنك
محتويات الموضوع
ما هو عنصر الزنك Zinc؟
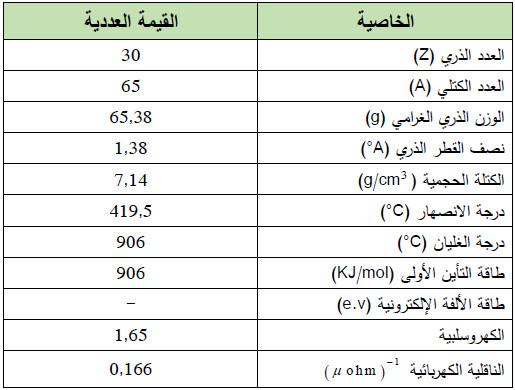
– الزنك أو الخارصين أو التوتياء هو عنصر من عناصر الجدول الدوري: العدد الذري = 30 ، العدد الكتلي = 65
– الرمز الكيميائي لعنصر الزنـك يرمز له بالرمز: 65Zn30
– التوزيع الإلكتروني له: Ar]18 4s2 3d10]
– هو فلز انتقالي رمادي فضي صلب، ولكنه في درجات تتراوح من 100- 150 مo يصبح قابلاً للطرق والسحب، ومقاوم للصدأ.
– يشتعل عند حوالي 1000مo معطياً لهباً أبيض.
– هو معدن ضعيف النفاذية المغناطيسية.
– كما أنه أكثر هشاشة فيمكن سحقه بالضرب.
– الزنك معدن موصل للكهرباء ولديه درجة انصهار منخفضة.
– الجدول التالي يوضح الخواص العامة لعنصر الزنـك كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Zinc
– اكتشف معدن الزنك منذ القدم، ويقال بأن اسمه اشتق من الألمانية Zink بمعنى قمم مسننة (نتوه).
– ويرجع ذلك إلى شكل الراسب المتكون أثناء تحضير الزنك لحظة خروجه من الأفران.
– كما يوجد الزنـك بنسبة 0.02% من وزن القشرة الأرضية.
طرق تحضير الزنك Preparation of Zinc
– يُحضر معدن الزنك غالباً من مركباته الكبريتية.
– ويتم ذلك بطريقتين حسب تركيزه في الصخر، وذلك إما بالترسيب أو الصهر والحرق باستخدام غاز ثاني أكسيد الكبريت الناتج عن صناعة حمض الكبريتيك.
– ثم يعالج أكسيد الزنـك الناتج ZnO بواسطة حمض الكبريتيك المخفف.
– وبعدها يتم تحليل كبريتات الزنـك ZnSO4 المتشكلة كهربائياً على مهبط من الألومنيوم فنحصل على معدن الزنـك النقي الذي تبلغ نقاوته 99.95%.
ZnO + C→ Zn + CO
كما يحضر حسب التفاعلات الآتية كما يلي:
ZnS + 3/2O2 → ZnO + SO2
ZnCO3 → ZnO + CO2
ZnO + C → Zn + CO
الخواص الكيميائية للزنك Chemical properties of Zinc
يحتل الزنـك مكاناً بين المعادن الفعالة كيميائياً ومن أهم التفاعلات تذكر التفاعلات الآتية كما يلي:
(1) التفاعل مع الأكسجين
يتفاعل الأكسجين مع الزنـك وذلك بالتسخين حيث يتشكل أكسيد الزنـك كما بالمعادلة الآتية:
Zn + 1/2O2 → ZnO
(2) التفاعل مع الماء
يتفاعل الزنك مع الماء مشكلاً هيدروكسيد الزنـك وانطلاق غاز الهيدروجين كما بالمعادلة الآتية:
Zn +2H2O → Zn(OH)2 + H2
(3) التفاعل مع الأحماض
ينحل الزنك بسهولة في الأحماض، فيرجع HNO3 الممدد إلى شاردة الأمونيوم كما بالمعادلة الآتية:
4Zn +10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
(4) التفاعل مع القواعد
يتفاعل الزنك مع القواعد المركزة فيعطي أملاح الزنكات كما بالمعادلة الآتية:
Zn + 4NaOH → Na2 (Zn(OH)4) + 2Na
(5) التفاعل مع الهاليدات
يتفاعل الزنك مع الهاليدات مشكلاً هاليد الزنـك وذلك كما بالمعادلة الآتية:
Zn + 2HX → ZnX2 + H2
في حالة تفاعل كلور الهيدروجين مع الزنـك ينتج كلوريد الزنـك كما بالمعادلة الآتية:
Zn + 2HCl → ZnCl2 + H2
استخدامات الزنك Uses of Zinc
– يستخدم معدن الزنـك لأغراض عدة منها تكوين طبقة على سطوح المعادن بنسبة 40% وتتم عملية تكوين هذه الطبقة بعدة طرق منها غمس المعادن في مصهور الزنـك أو الرش بالزنـك السائل.
– كما أن كمية كبيرة من معدن الزنـك تستخدم في صناعة البطاريات الجافة.
– يستخدم كبريتيد الزنـك في دهن لعب الأطفال، فهو أقل ضرر عند استنشاقه.
المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- العناصر الانتقالية – كتاب الصف الثالث الثانوي – جمهورية مصر العربية 2021