التيلوريوم Tellurium – الخواص الفيزيائية والكيميائية للتيلوريوم
محتويات الموضوع
ما هو عنصر التيلوريوم Tellurium؟
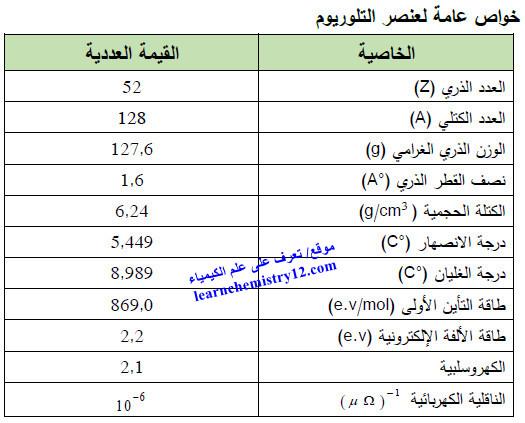
– التيلوريوم Tellurium هو عنصر من عناصر الجدول الدوري: العدد الذري = 52 ، العدد الكتلي = 128
– الرمز الكيميائي لعنصر التيلوريوم يرمز له بالرمز: 128Te52
– التوزيع الإلكتروني له: Kr]36 5s2 4d10 5p4]
– التيلوريوم فلز هش فضي أبيض يشبه القصدير، مرتبط كيميائيًا بالسيلنيوم والكبريت.
– يستخدم أساساً في صناعة السبائك ويستخدم كشبه موصل.
– التيلوريوم هو أحد أندر 10 عناصر على هذا الكوكب.
– يمكن أن يتخذ التلوريوم النقي شكلين: مادة صلبة معدنية لامعة أو مسحوق بني.
– الجدول التالي يوضح الخواص العامة لعنصر التيلوريوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Tellurium
– اكتشف عنصر التيلوريوم عام 1782م الكيميائي النمساوي فرانز مولر فون رايخنشتاين (رومانيا).
– أصل الاسم مشتق من الكلمة اللاتينية Tellus ومعناها الأرض.
– ويمكن الحصول على عنصر التلوريوم النقي عادة كناتج ثانوي من تنقية النحاس.
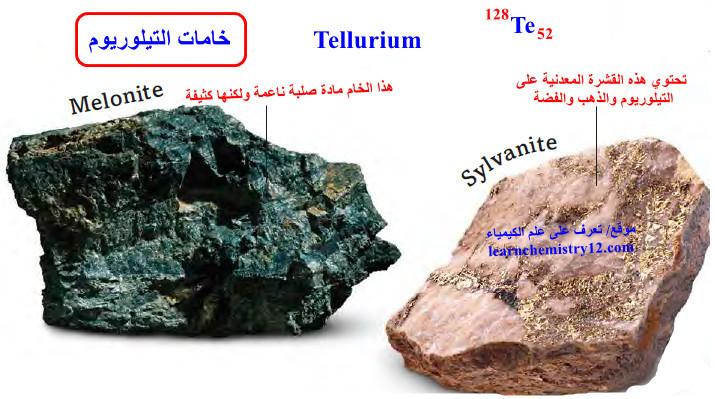
– وغالبًا ما يوجد هذا العنصر في الطبيعة متحدًا مع فلزات كالنحاس والذهب والرصاص والزئبق والفضة.
– غالبًا ما يوجد هذا العنصر كمركب مع عنصر آخر، مثل معدن النيكل، كما في حالة خام Melonite.
– يتم إنتاج التلوريوم أيضًا كمنتج نفايات عند تكرير الرصاص والنحاس.
– تحتوي القشرة المعدنية في خام Sylvanite كما بالصورة على التلوريوم والذهب والفضة
طرق تحضير التيلوريوم Preparation of Tellurium
– يفصل التيلوريوم من خامات البزموث وهي تلوريد البزموث Bi2Te3 بمعاملتها بكربونات الصوديوم لتحويله إلى تلوريد الصوديوم NaTe الذي ينفصل منه التلوريوم عند تركه في الهواء على هيئة مسحوق رمادي اللون.
مركبات التيلوريوم Compounds Tellurium
أكاسيد التيلوريوم Oxides Tellurium
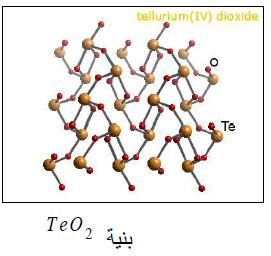
– عند أكسدة التيلوريوم بحمض النتريك يتشكل لنا ثنائي أكسيد التلوريوم TeO2، الذي يكون على هيئة بلورات لا لون لها وهو شحيح الذوبان في الماء ولا يكون معه محلولاً حمضياً.
– يمكن تحضير بعض الأحماض من هذا الأكسيد مثل حمض التيلوريوم H2TeO3 ذو درجة الأكسدة (+4) بتخفيف محلول التلوريوم في حمض النتريك.
– ويمكن أكسدة هذا الحمض إلى حمض التلوريك H2TeO4 بواسطة برمنغنات البوتاسيوم كما بالمعادلات الآتية:
TeO2 + H2O→ H2TeO2
H2TeO2 + KMnO4 → H2TeO4
– يمكن الحصول على أملاح التلورات بصهر التلوريوم مع كربونات الصوديوم ونترات الصوديوم والبوتاسيوم، وأيضاً بأكسدة تلوريت البوتاسيوم مثلاً بغاز الكلور.
K2TeO3 + Cl2 + H2O → K2TeO4 + 2HCl
– عند احتراق التلوريك يتحول إلى ثالث أكسيد التيلوريوم TeO3 الذي قد ينحل بعد ذلك إلى ثاني أكسيد التلوريوم والأكسجين.
H2TeO4 + O2 → TeO3 + H2O → TeO2 + 1/2O2
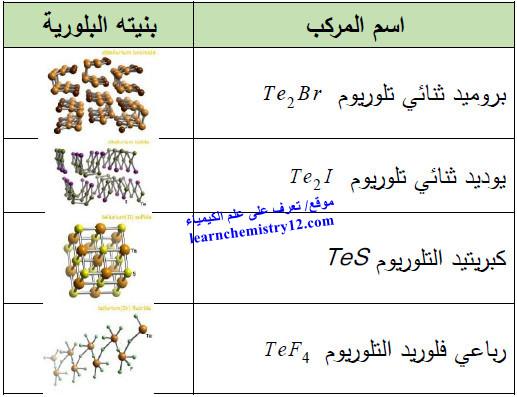
مركبات أخرى
الجدول التالي يوضح المركبات المهمة الأخرى للتلوريوم كما يلي:
الخواص الكيميائية لعنصر التيلوريوم Chemical properties of Tellurium
– رغم أن خواص التيلوريوم الفيزيائية تشبه فلز الزنك فإن خواصه الكيميائية تشبه خواص اللافلزات مثل الزرنيخ.
(1) التفاعل مع الهواء
– يشتعل التلوريوم في الهواء مكوناً ثنائي أكسيد التيلوريوم TeO2 كما بالمعادلة الآتية:
Te(s) + 2O2(g) → TeO2(s)
– ويتكون هذا الأكسيد أيضاً بأكسدة التلوريوم بحمض النتريك على هيئة بلورات لا لون لها، وهو شحيح الذوبان في الماء ولا يكون معه محلولا حمضياً.
(2) التفاعل مع الهالوجينات
– يتم الأتحاد بالهالوجينات مباشرة، فيكون مع الفلور رباعي وسداسي فلوريد التيلوريوم TeF4 ، TeF6 كما بالتفاعلات التالية:
برتقالي Te8(s) + 24F2(g) → 8TeF6
Te8(s) + 16F2(g) → 8TeF4
– ويكون مع الكلور، البروم واليود على التوالي رباعي كلوريد التيلوريوم، رباعي بروميد التوريوم ورباعي يوديد التلوريوم كما بالتفاعلات التالية:
Te8(s) + 16Cl2(g) → 8TeCl4
Te8(s) + 16Br2(g) → 8TeBr4
– أما فى حالة اليود:
Te8(s) + 16I2(g) → 8TeI4
(3) التفاعل مع الهيدروجين
– ينتج تلوريد الهيدروجين عند تفاعل حمض الهيدروكلوريك مع تلوريد المغنسيوم كما بالمعادلة التالية:
MgTe + 2HCl → MgCl2 + TeH2
– وتلوريد الهيدروجين سائل عند درجة 0 مo، ويتحول إلى مادة صلبة عند 40 مo، وهو غاز في درجات الحرارة العادية ويتفكك في وجود الضوء أو في الهواء الرطب ويترسب منه التلوريوم.
استخدامات التيلوريوم Uses of Tellurium
– ظل التيلوريوم أمداً طويلاً ليس له سوى تطبيقات محدودة.
– يستعمل أساساً في تحسين خواص الكابلات المغلفة بالرصاص، فقليل من التيلوريوم (أقل من 0%، 1) يكفي لزيادة مقاومة الرصاص فيزيائياً وكيميائياً.
– ثم أصبح هذا العنصر فجأة مهماً لسبب خاص يعود إلى الدور الذي يريد الفيزيائيون أن يحملوه إياه، فلقد اكتشفوا أن بعض مركبات التلوريوم هي أنصاف نواقل ذات طبيعة خاصة يمكن استعمالها لكشف الإشعاع تحت الأحمر، وخاصة من أجل تحويل الحرارة مباشرة إلى كهرباء.
– علاوة على ذلك فأن التيلوريوم يحمي البرونز من التآكل بسهولة في الهواء.
– يستخدم هذا العنصر بشكل أساسي في زجاج الألياف الضوئية، والتي تحمل كميات كبيرة من المعلومات بشكل أسرع بكثير من الكابلات النحاسية.
– ترتبط الألواح الشمسية بخلايا طاقة تحتوي على التيلوريوم.
– يأتي اللون الأحمر الغامق من إضافة التلوريوم كما بالصورة المرفقة أدناه.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.