الإربيوم Erbium – الخواص الفيزيائية والكيميائية للإربيوم.
محتويات الموضوع
ما هو عنصر الإربيوم Erbium؟
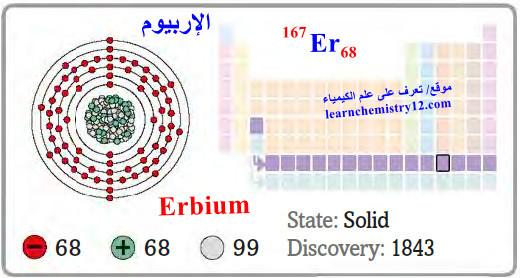
– الإربيوم Erbium هو عنصر من عناصر الجدول الدوري: العدد الذري = 68 ، العدد الكتلي = 167
– الرمز الكيميائي لعنصر الإربيوم يرمز له بالرمز: 167Er68
– التوزيع الإلكتروني له: Xe]54 6s2 4f12]
– الإربيوم هو أحد العناصر الفلزية الأرضية النادرة، لونه فضي.
– ثابت تقريباً في الهواء ولا يتأكسد فيه بنفس السرعة التي يتأكسد بها بعض الفلزات الأرضية النادرة الأخرى.
– كما أن هذا العنصر الفضي يفقد بريقه ببطء عند ملامسته للهواء.
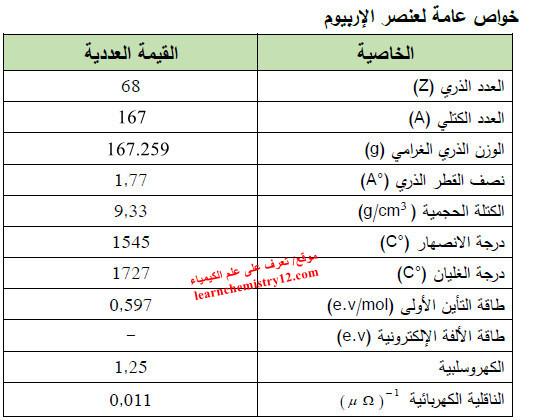
– الجدول التالي يوضح الخواص العامة لعنصر الإربيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Erbium
– تم اكتشاف الإربيوم من قبل كارل جوستاف مونسادير في عام 1843م.
– قام مونسادير بعزل (اليتريا) من معدن الجادولينايت لثلاثة أجزاء تسمى يتريا، إربيا، تربيا.
– قام بتسمية العنصر الجديد على اسم بلدة تسمى يتربى Ytterby والتي يتواجد فيها كميات كبيرة من اليتريا التي تحتوي على الإربيوم.
– الإربيا والتيربيا، كانا يسببان بعض التشويش وقتها.
– بعد عام 1860م، تم إعادة تسمية التيربيا إلى إربيا وبعد عام 1877م ما كان يعرف بالإربيا تم إعادة تسميته إلى تيربيا.
– تم عزل الإربيوم النقي في عام 1905م بواسطة جورج أوربان وكارليس جيمس.
– لم يتم إنتاج الفلز حتى 1934م عندما قام العمال بتقليل الكلور المائي ببخار البوتاسيوم.
– مثل العناصر الأرضية النادرة الأخرى لا يتواجد العنصر حراَ في الطبيعة ولكن يتواجد في تراب خام المونازيت Monazite.
– كما يتواجد الإربيوم مع عدد من العناصر الأخرى في معدن الجادونيلايت والذي يتواجد في يتربي Ytterby في السويد.
تحضير الإربيوم Preparation of Erbium
– يعتبر الزينوتايم الإيوكسنايت المصدر الأساسي للإربيـوم.
– يتم تحضيره باستخدام تقنية التبادل الأيوني التي تم تطويرها في أواخر القرن العشرين.
مركبات الإربيوم Erbium Compound
(1) ثلاثي أكسيد ثنائي الإربيوم Er2O3
– يحترق الإربيوم بسهولة ليشكل ثلاثي أكسيد الإربيوم.
– هو مركب لا ينحل في الماء فهو ينحل في الأحماض المعدنية.
– كما أنه يمتص بسهولة الرطوبة وثاني أكسيد الكربون الموجود في الهواء.
(2) ثلاثي كلوريد الإربيوم ErCl3
– يمكن لثلاثي أكسيد ثنائي الإربيـوم أن يتفاعل مع الأحماض، فتفاعله مع حمض الهيدروكلوريك يعطي ثلاثي كلوريد الإربيـوم كما بالتفاعل التالي:
Er2O3 + 6HCl → 2ErCl3 + 3H2O
(3) ثلاثي كلوريد هكسا هيدرات الإربيوم ErCl3.6H2O
– يتميز انهيدريد الإربيـوم الثلاثي باللون البنفسجي وهو صلب ويمكن أن يعطي ثلاثي كلوريد هكسا هيدرات الإربيـوم ErCl3.6H2O بالتسخين والذي يتميز بشكله البلوري ولونه الوردي.
(4) هيدروكسيد الإربيوم Er(OH)3
– يمكن لثلاثي كلوريد الإربيـوم أن يتفاعل مع القواعد ليعطي هيدروكسيد الإربيـوم كما بالتفاعل التالي:
ErCl3 +3XOH → Er(OH)3 + 3XC
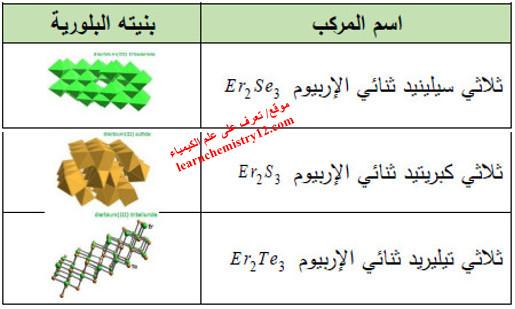
(5) مركبات أخرى
– يوجد أيضاً مركبات أخرى مشهورة لهذا العنصر كما يلي:
الخواص الكيميائية لعنصر الإربيوم Chemical properties of Erbium
– هو عنصر ثلاثي التكافؤ، وهو يشبه العناصر الأرضية النادرة الأخرى.
– تتحدد خواص الإربيـوم بدرجة الشوائب الموجودة.
(1) التفاعل مع الهواء
– الإربيوم المعدني يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثلاثي أكسيد الإربيـوم كما بالتفاعل التالي:
4Er + 3O2 → 2E2O3
(2) التفاعل مع الماء
– معدن الإربيوم الأبيض الفضي اللون ذو الكهرو إيجابية العالية فيتفاعل ببطيء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد الإربيـوم كما بالتفاعل التالي:
2Er(s) + 6H2O(g) → Er(OH)3(aq) + 3H2(g)
(3) التفاعل مع الهالوجينات
– الإربيوم يتفاعل مع كل الهالوجينات ليعطي هاليدات الإربيـوم الثلاثية.
– حيث يتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي: ثلاثي فلوريد الإربيـوم، ثلاثي كلوريد الإربيـوم، ثلاثي بروميد الإربيـوم ثلاثي يوديد الإربيـوم، كما بالتفاعلات التالية:
وردي 2Er(s) + 3F2(g) → 2ErF3(s)
بنفسجي 2Er(s) + 3Cl2(g) → 2ErCl3(s)
– ويتفاعل أيضاً مع البروم واليود بنفس الطريقة كما يلي:
بنفسجي 2Er(s) + 3Br2(g) → 2ErBr3(s)
بنفسجي 2Er(s) + 3I2(g) → 2ErI3(s)
(4) التفاعل مع الأحماض
– الإربيوم يذوب بسهولة في حمض الكبريتيك ليعطي محلول بلون أصفر كما بالتفاعل التالي:
2Er(s) + 3H2SO4(aq) → 2Er3+(aq) + 3SO42-(aq) + 3H2(g)
استخدامات الإربيوم Uses of Erbium
(1) تختلف الاستخدامات اليومية للإربيوم. فإنه يستخدم غالباً كمرشح للتصوير الفوتوغرافي ونظرا لطواعيته فإنه مفيد في إضافته للفلزات.
(2) يستخدم في الأبحاث النووية كممتص للنيترون.
(3) كما يستخدم كعامل إشابة في المضخمات البصرية.
(4) علاوة على ذلك فأنه عند إضافته للفناديوم كسبيكة يقلل من صلابته ويحسن من القدرة على تشغيله.
(5) لأكسيد الإربيـوم لون وردي ولذلك فإنه يستخدم أحياناً كملون للزجاج والخزف. ويستخدم حينها الزجاج كعدسات في النظارات الشمسية الرخيصة.
(6) بالإضافة إلى ذلك تستخدم بلورات الإربيوم في عمل أشعة الليزر، والمضخمات البصرية.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017