الهافنيوم Hafnium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الهافنيوم Hafnium؟
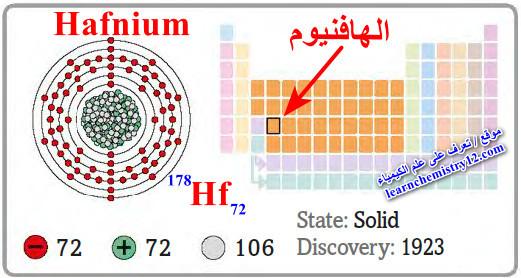
– الهافنيوم Hafnium هو عنصر من عناصر الجدول الدوري: العدد الذري = 72، العدد الكتلي = 178
– الرمز الكيميائي لعنصر الهافنيوم يرمز له بالرمز: 178Hf72
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d2]
– الهافنيوم من العناصر الانتقالية رباعية التكافؤ.
– فلز له خواص ميكانيكية ممتازة.
– يمتص النيترونات بشكل ممتاز.
– يعتبر أول عنصر يكتشف بأشعة X.
– كما أنه يشبه كثيراً عنصر الزركونيوم في البنية الالكترونية.
– الشكل التالي يوضح عينة مختبرية من الهافنيوم النقي كما يلي:
– الشكل النقي لهذا العنصر مقاوم للتآكل في الهواء.
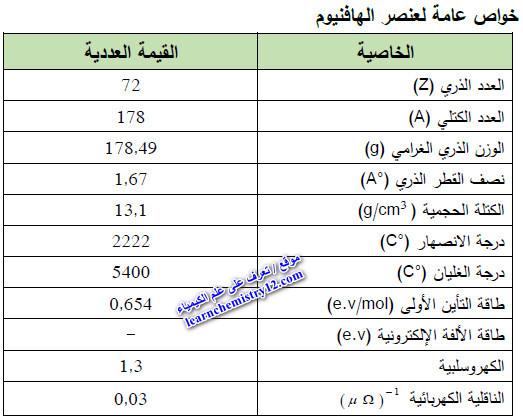
– الجدول التالي يوضح الخواص العامة لعنصر الهافنيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Hafnium
– اكتشف الهافنيوم من قبل العالمين (ديرك كوشتر) و (جيورجي هفرسي) عام 1923م.
– اشتق اسمه من مدينة كوبنهاجن Copenhagen باللاتينية Hafnia
– يعتبر أول عنصر اكتشف بالأشعة السينية.
– يوجد فلز الهافنيوم مرافقاً للزركونيوم، ففي أي مكان يوجد الزركونيوم يوجد الهافنيوم ولو بكميات قليلة.
– يوجد العنصران معاً في بلورات معدن الزركون Zircon وتكون ذراتهما متشابهة في الحجم.
– هناك تشابه بين الفلزين الناتج عن البينة الإلكترونية وتساوي نصفي قطريهما، لذلك فصلهما يحتاج إلى 500 عملية إذابة وتبلور، تعتمد جميعها على التباين الطفيف جداً في ذوبانية أملاح هذين العنصرين.
تحضير الهافنيوم Preparation of Hafnium
– تشكل كلوريدات الهافنيوم والزركونيوم معقدات ثابتة جداً مع أوكسلات كلوريد الفوسفور POCl3)2, (HfCl4)3, (ZnCl4)3, (POC13)2) وهي ذات درجات غليان مختلفة، ويساعد هذا الاختلاف في فصل كلا الفلزين عن بعضهما.
– إن الطريقة الأنجح لفصلهما عن بعضهما هي طريقة كروماتوغرافيا العمود.
– إذ بعد تمديد محاليل كلوريديهما في الميثانول اللامائي عبر عمود فصل كروماتوغرافي سليكا جل السيليس كحامل وطور سائل متحرك لحمض الهيدروكلوريك HCl تركيزه 1.9 مولاري مع الميثانول نحصل أولاً على فلز الزركونيوم ثم الهافنيـوم، لأنه أكثر امتزازاً على الحامل من الزركونيوم.
– يستخلص بعد ذلك الهافينيوم بواسطة محلول حمض الكبريتيك تركيزه 7M.
الخواص الكيميائية لعنصر الهافنيوم Chemical properties of Hafnium
– لا يجمع الهافنيوم بسهولة مع الأكسجين في الهواء والماء.
– لا يتفاعل مع الأحماض الضعيفة.
– من بين مركباته نذكر المركبات الآتية كما يلي:
(1) أكسيد الهافنيـوم الرباعي
– مركب كيميائي صيغته HfO2
– يكون على شكل بلورات بيضاء إلى زهرية اللون.
– يعد واحداً من أكثر المركبات ثباتاً وشيوعاً بالنسبة لعنصر الهافنيوم.
– لا ينحل في الماء لكنه يتفاعل مع الأحماض القوية مثل: حمض الكبريتيك المركز.
– كما يتفاعل مع القواعد القوية لذا يعد من الأكاسيد المذبذبة.
– يتفاعل مع الكلور في درجات حرارة مرتفعة بوجود الجرافيت أو رباعي كلور الميثان ليعطي كلوريد الهافنيـوم الرباعي.
(2) هاليدات الهافنيـوم
– يتفاعل الهافنيـوم بالتسخين مع أحد الهالوجينات ويتشكل المركبات الآتية كما يلي: HfX2 , HfX3 , HfX4
(3) كربيد الهافنيوم الرباعي
– مركب كيميائي صيغته HfC.
– يكون على شكل مسحوق رمادي.
– كذلك يمكن الحصول عليه من الاختزال الكربو حراري لأكسيد الهافنيـوم باستخدام الجرافيت.
– لا ينحل كربيد الهافنيوم في الماء، يمتاز بصلادته وارتفاع درجة انصهاره.
(4) تفاعله مع الكبريت
– يتفاعل الهافنيـوم مع الكبريت ليشكل ثاني كبريت الهافنيوم HS2 كما بالمعادلة التالية:
Hf + 2S → HfS2
استخدامات الهافنيوم Uses of Hafnium
– يستخدم الهافنيوم في القواطع القوية التي تخترق الأجسام المعدنية بتيار ساخن من الشرر كما بالشكل التالي:
– كما يستخدم معظم الهافنيـوم المنتج في تصنيع قضبان التحكم في المفاعلات النووية.
– كذلك يستخدم الهافنيـوم في سبائك الحديد والتيتانيوم والنيوبيوم والتنتالوم ومعادن أخرى مثل السبيكة المستخدمة لفوهات دفع الصواريخ السائلة.
– يستخدم الهافنيـوم أيضًا كقطب كهربائي في قطع البلازما نظرًا لقدرته على إلقاء الإلكترونات في الهواء.
– كما يتم استخدامه أيضًا في تصنيع إلكترونيات صغيرة جدًا – لا يتجاوز عرضها بضعة أجزاء من المليون من المليمتر – في الرقائق الدقيقة كما بالشكل التالي:
– علاوة على ذلك تُستخدم نظائر الهافنيوم أيضًا في الكيمياء الجيولوجية النظيرية والتطبيقات الجيولوجية الزمنية.
– نظرًا لمقاومته للحرارة وقابليته للأكسجين والنيتروجين، يعتبر الهافنيوم كاسحًا جيدًا للأكسجين والنيتروجين في المصابيح المملوءة بالغاز والمتوهجة.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017