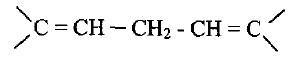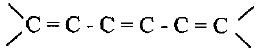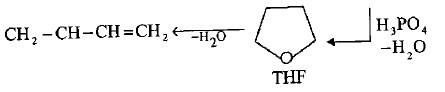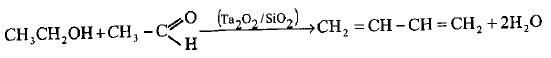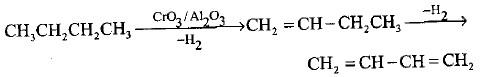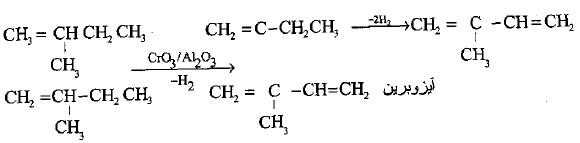الدايينات Dienes (الألكينات الثنائية)
الألكينات الثنائية (الدايينات) Dienes
– تسمى الهيدروكربونات الحاوية على رابطتي C=C بالدايينات (الألكينات الثنائية) Dienes
– يمكن تقسيم الدايينات اعتماداً على موقع هذه الروابط من بعضها البعض إلى ثلاثة أنواع من المركبات كما يلي:
(1) الروابط المزدوجة المتجمعة Cumulated
– وهي التي تكون متجاورة ولا تفصل بينها أية رابطة أحادية.
(2) الروابط المزدوجة المنفصلة Isolated dienes
– وهي الروابط التي تكون بعيدة عن بعضها البعض بأكثر من ذرة كربون مشبعة وتكون مستقلة الواحدة عن الأخرى ولا علاقة بينهما كيميائياً.
(3) الروابط المزدوجة المتبادلة (المقترنة) Conjugated dienes
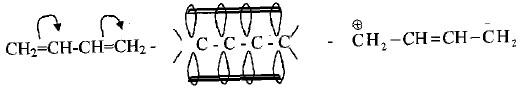
– وهي الروابط المزدوجة التي لا تفصل بينهما سوى ذرة كربون واحدة حيث يسمح تتداخل أفلاك الإلكترونات فيما بينها مما يسمح للإلكترونات الانتقال عبر الأفلاك P من ذرة كربون إلى أخرى على طول سلسلة المركب.
– وعند اختبار استقرارية المركبات الحاوية على مثل هذه الروابط المزدوجة فقد تبين أن الدايينات المقترنة هي الأكثر استقراراً لأن تداخل الأفلاك 2P للروابط المقترنة غير المرتبطة سيكون محتملاً ويكون فوق وتحت السلسلة، الأمر الذي يسمح بانتقال الالكترونات وعدم تمركزها وتموضعها على طول السلسلة مما يزيد من استقرار الحالات الوسطية للتفاعل.
– أن أهم ثلاث مركبات دايينات هي:
(1) بيوتادايين Butadiene
– يعتبر الرمز التاريخي للدايينات المقترنة كما يعتبر المادة الأولية لتحضير المطاط الصناعي بونا (Buna).
– يعتمد تحضيره على الاستيلين، الايثانول أو على جزء البيوتان المستخرج من الغازات المحطمة.
– يحضر مركب البيوتادايين من خلال الطرق التالية:
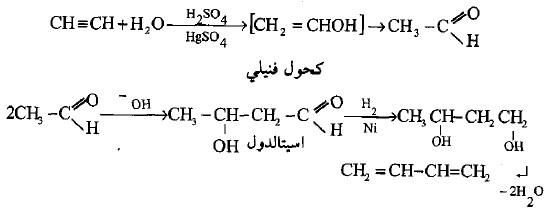
(أ) إضافة الماء إلى الأستيلين في الوسط الحامضي
– عند إضافة الماء إلى الأستيلين في الوسط الحامضي وبوجود حفاز (كبريتات الزئبقيك) فأن الناتج النهائي سيكون الأسيتالدهيد الذي يزدوج في الوسط القاعدي لإعطاء المركب أسيتالدول (تكاثف ألدول).
– عند تعريض المركب الأخير إلى هدرجة جزئية في حرارة 110°م وضغط 300 جو فأن مجموعة ألدهيد ستتحول إلى الكحول الثنائي المقابل (بيوتان – 3،1 – دايول) الذي يفقد جزيئتي ماء عند تسخينه مع ملح مادرل (بولي فوسفات الصوديوم) ليتحول إلى 3،1 بيوتادايين.
(ب) تفاعل الأستيلين مع الفورمالدهيد
– هنالك طريقة صناعية تتضمن التفاعل بين الأستيلين مع محلول مائي 30% من الفورمالدهيد بوجود استيليد النحاس كعامل حفاز ودرجة حرارة o100 م وضغط 5 جو (طريقة ريبي Reppe).
– في هذا التفاعل فأن المركب -2- بيوتاين 4،1- دايول سيتكون مع كميات قليلة من كحول البروبارجيل.
– عند الهدرجة المحفزة لمركب البيوتاين دايول عند حرارة o200 م وضغط 280 جو فأنه يتحول إلى الدايول المشبع المقابل الذي يعطي الفيوران المشبع (رباعي هايدرو – فيوران) عند معاملته مع حامض الفسفوريك الساخن.
– يفقد الفيوران المشبع جزيئة ماء عند تسخينه مع بولي فوسفات الصوديوم عند درجة o270م ليعطي 3،1- بيوتاداين كما يلي:
(جـ) سحب الهيدروجين والماء من الكحول الايثيلي
– سحب الهيدروجين والماء من الكحول الايثيلي (طريقة ليبيديف Lebedeev) في الحالة البخارية الساخنة وذلك من خلال إمرار البخار على حفاز السليكات في درجة حرارة o400 م حيث يكون منتوج البيوتادايين بحدود 35%.
– كما يمكن زيادة المنتوج إلى 75% حين يتفاعل مزيج من الايثانول والاسيتالدهيد الدهيد بوجود حفاز السيلكا جل (Silica-gel) الحاوي على 2% من أكسيد التنتالوم (Ta2O2).
(د) سحب الهيدروجين المحفز لمركب البيوتان المستقيم النقي أو البيوتين
– يحضر البيوتادايين بشكل واسع ورئيسي من خلال سحب الهيدروجين المحفز لمركب البيوتان المستقيم النقي أو البيوتين المستخرج من الغازات المتكسرة.
– يجرى التفاعل في درجة حرارة o600م وضغط 0.15 جو باستخدام مزيج Al2O3 / CrO3 كحفاز (طريقة هاودري Houdry) كما يلي:
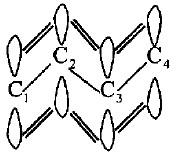
– لعل سر ثبات مركب البيوتاديين يرجع بالأساس إلى سهولة نشر الالكترونات (π) على طول السلسلة من خلال تجاور الأفلاك الجزيئية (P) واختلاطها سيما فلكي C3 ، C4 الذي يكمل اختلاط فلكي C1 وفلكي C4 كل على حدة وبالتالي يجعل جزيئة البيوتادايين محاطة من الأعلى ومن الأسفل بغيمة الكترونية تساهم في انتقال الكترونات (π) على الذرات الأربع مما يقلل من طاقتها ويزيد من استقرارها.
– الدلائل العلمية تشير إلى هذه الاستقرارية والثبات من خلال أطوال الروابط الموجودة علاوة على قياسات حرارة الهدرجة للبيوتان مقارنة مع بعض الألكينات المشابهة، فالروابط المزدوجة تكون أطوالها oA 1.47 وهي أقل من رابطة C-C المنفردة (oA 1.54) وهذا ما يجعلها تقترب من الرابطة C=C المزدوجة (oA 1.34).
– بقسمة حرارة الهدرجة للدايينات المقترنة على عدد الروابط المزدوجة الموجودة فيها ومقارنتها مع الألكينات المشابهة لها في عدد ذرات الكربون نجد أن حرارة الهدرجة للأولى تقل بمقدار 3.5 كيلو سعرة. مما يشير وبوضوح إلى استقرارها وثباتها ويدل على أن الاقتران أو التبادل هو السبب في قوة روابط SP2-SP2 في الدايينات المقترنة إضافة إلى انتشار الكترونات (π) على عموم ذرات الكربون للمركب.
(2) الأيزوبرين Isoprene
– يعتبر الايزوبرين هو وحدة البناء للمطاط الطبيعي. ويمكن الحصول عليه من خلال التقطير الاتلافي للمطاط (طريقة وليامز 1861 Williams). كما أن هذا المركب (باستخدام حفازات زیکلر – ناتا) أصبح له أهمية صناعية عظيمة حيث أن المركب بولي آيزوبربين (ناتسين Natsyn) له صفات قريبة جداً ومشابهة للمطاط الطبيعي.
– يحضر مركب الأيزوبرين بالطرق الآتية كما يلي:
(أ) سحب الهيدروجين من الآيزوبنتان أو الآيزوبنيتن
– صناعياً يحضر الآيزوبرين من الآيزوبنتان أو الآيزوبنيتن المستخرج من البترول أو الغازات المتكسرة بعملية سحب الهيدروجين تحت تأثير العامل الحفاز Al2O3/CrO3.
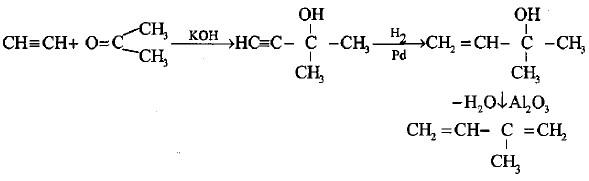
(ب) إضافة الأستيلين إلى الأسيتون
– يحضر الآيزوبرين من إضافة الأستيلين إلى الأسيتون بوجود مسحوق هيدروكسيد البوتاسيوم حيث يتكون أولاً مركب ثنائي مثيل ايثاينايل كاربينول والذي يتحول إلى ثنائي مثيل فنيل كاربينول بالهدرجة الجزيئة.
– عند سحب الماء من المركب الأخير في الحالة البخارية بواسطة إحدى المجففات مثل أكسيد الألمنيوم يتكون مركب الأيزوبرين (طريقة فافورسكي.Favorski 1906).
(3) ثنائي مثيل بيوتادايين Dimethyl butadiene
– يحضر هذا المركب من سحب الماء من مركب البيناكول (والذي يحضر من الأسيتون بإمرار بخاره على عامل مجفف (Al2O3).
– كما يستخدم هذا المركب صناعياً كمادة أولية في صناعة مطاط المثيل (طريقة فرتز هوفمان Fritz Hofmann).
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States