الكيمياء هي علم دراسة المادة، تركيبها، خواصها، والتفاعلات التي تحدث بينها. تهتم بفهم كيفية تغيير المواد تحت ظروف مختلفة، ولها تطبيقات واسعة في الحياة اليومية والصناعة والطب.
الكيمياء
-
مسائل محلولة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة
فى هذا الموضوع سوف نستعرض (8) مسائل بأفكار مختلفة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة حيث قمنا بعرض الإجابات…
أكمل القراءة » -
طاقة جبس الحرة Gibbs Free Energy
طاقة جبس الحرة Gibbs Free Energy – طاقة جبس الحرة هي خاصية ثيرموديناميكية تجمع بين أنتروبي وإنثالبي النظام من أجل تحديد…
أكمل القراءة » -
الطرق الفيزيائية لتعيين الوزن الجزيئي لمركب كيميائي
الطرق الفيزيائية لتعيين الوزن الجزيئي لمركب كيميائي Physical Methods for Determination of Molecular Formula يتم تحديد الوزن الجزيئي…
أكمل القراءة » -
التحاليل الطبية: الفحص الكيميائي الشامل لعينات البول Urine
الفحص الكيميائي لعينات البول Chemical Examination of Urine يشمل الفحص الكيميائي لعينات البول Urine الآتي: (1) الزلال Albumin (2) السكر Glucose (Sugar) (3) الأجسام الكيتونية Ketone bodies…
أكمل القراءة » -
الفحص الكيميائي للبول: تحليل الدم – تحليل أملاح الصفراء – تحليل البيليروبين
الفحص الكيميائي للبول Chemical Examination of Urine يشمل الفحص الكيميائي للبول الآتي: (1) الزلال Albumin (2) السكر Glucose (Sugar) (3) الأجسام الكيتونية Ketone bodies (Acetone) (4)…
أكمل القراءة » -
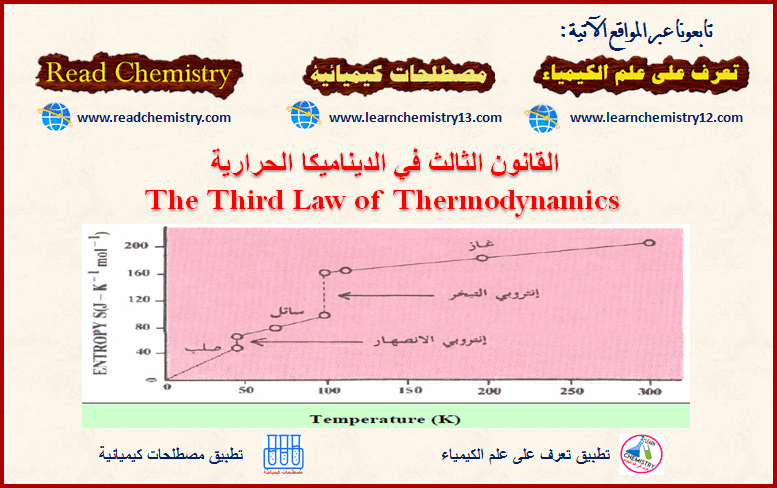
القانون الثالث للديناميكا الحرارية 3th Law of Thermodynamics
القانون الثالث للديناميكا الحرارية (الأنتروبي القياسي Standard Entropy) – ينص القانون الثالث للديناميكا الحرارية على أن: (الأنتروبي لأي مادة نقیة…
أكمل القراءة » -
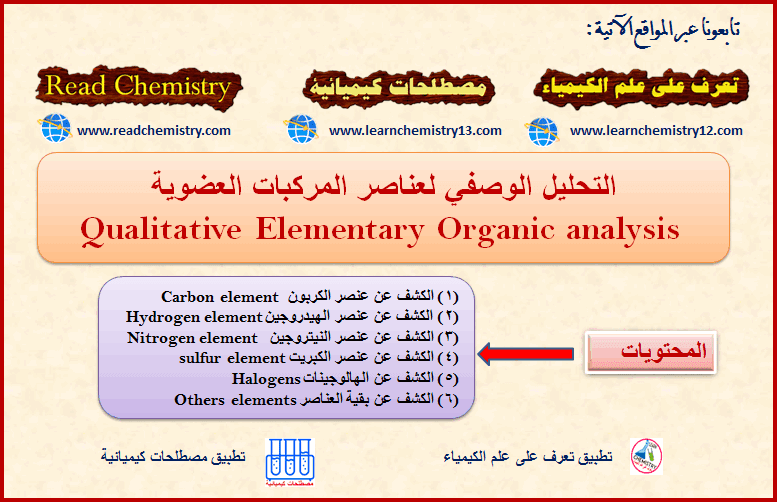
التحليل الوصفي لعناصر المركبات العضوية Qualitative analysis
عند تحضير مركب عضوي لأول مرة في حالته النقية فإن الخطوة التالية هي معرفة العناصر التي يتضمنها هذا المركب.…
أكمل القراءة » -
الطرق العملية للحصول على المركبات العضوية نقية
المركبات العضوية النقية Pure Materials – يتطلب العمل العملي البحثي التعامل مع أو عزل المركبات العضوية النقية والتي تكون على…
أكمل القراءة » -
تحميل كتاب التطبيقات العملية في التحاليل الكيميائية الآلية وطرائق الفصل
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة » -
عنصر الكربون Carbon
أولاً: ما هو عنصر الكربون؟ ** الكربون عنصر من عناصر الجدول الدوري العدد الذري = 6 ، العدد الكتلي = 12…
أكمل القراءة » -
عنصر البورون Boron
أولاً: ما هو عنصر البورون؟ ** البورون B عنصر من عناصر الجدول الدوري العدد الذري=5 ، العدد الكتلي= 10 ** التوزيع…
أكمل القراءة » -
عنصر البيريليوم Beryllium
أولاً: ما هو عنصر البيريليوم؟ ** البيريليوم Be عنصر من عناصر الجدول الدوري العدد الذري= 4 ، العدد الكتلي= 9 **…
أكمل القراءة » -
تحميل كتاب أسس الكيمياء التحليلية – د/ محمد مجدى واصل
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع هذا الكتاب الرائع…
أكمل القراءة » -
الأملاح المتبلرة وماء التبلر Hydrates and Water of Crystallization
تعريف الأملاح المتبلرة Definition of Hydrates يدخل الماء مع أملاح وأيونات معينة مكوناً الملح المائي (Hydrates) ويمكن الحصول على…
أكمل القراءة » -
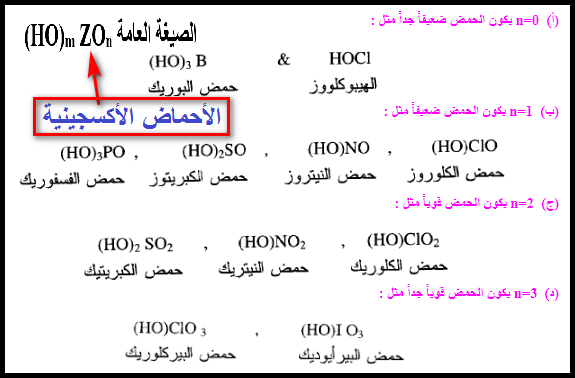
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular structure
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular (Formula) structure لمناقشة علاقة البنية الجزيئية وقوة الحمض…
أكمل القراءة » -
ثلاث كتب للتدريب للعمل في الصيدليات باللغة العربية بالمصطلحات الأنجليزية
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع ثلاث…
أكمل القراءة » -
تحضير الأحماض والقواعد والأملاح Preparation of acids, bases and salts
(ِأ)- تحضير الأحماض Preparation of acids نستطيع ان نجمل تحضير الأحماض بأحد الطرق الآتية: 1- الاتحاد المباشر لعنصري الحمض 2-…
أكمل القراءة » -
القوى النسبية للأحماض والقواعد Relative Strength of Acids and Bases
القوى النسبية للأحماض والقواعد Relative Strength of Acids and Bases ** قوة أي حمض HA في محلول مائي هو مقياس لقدرته…
أكمل القراءة » -
قانون دالتون للضغوط الجزئية Dalton’s Law of Partial Pressures
قانون دالتون للضغوط الجزئية كان من الاھتمامات الرئیسية للعالم دالتون دراسة الظروف المناخیة والجویة . ولقد احتفظ لمدة ٥٧…
أكمل القراءة » -
مسائل محلولة على الحرارة Solved problems on Heat
قبل البدء فى حل هذة المسائل يلزمك مراجعة المفاهيم والتعاريف والقوانين الأساسية فى الحرارة ولعمل لذلك اقرأ هذا الموضوع: تعريفات…
أكمل القراءة »