الكيمياء هي علم دراسة المادة، تركيبها، خواصها، والتفاعلات التي تحدث بينها. تهتم بفهم كيفية تغيير المواد تحت ظروف مختلفة، ولها تطبيقات واسعة في الحياة اليومية والصناعة والطب.
الكيمياء
-
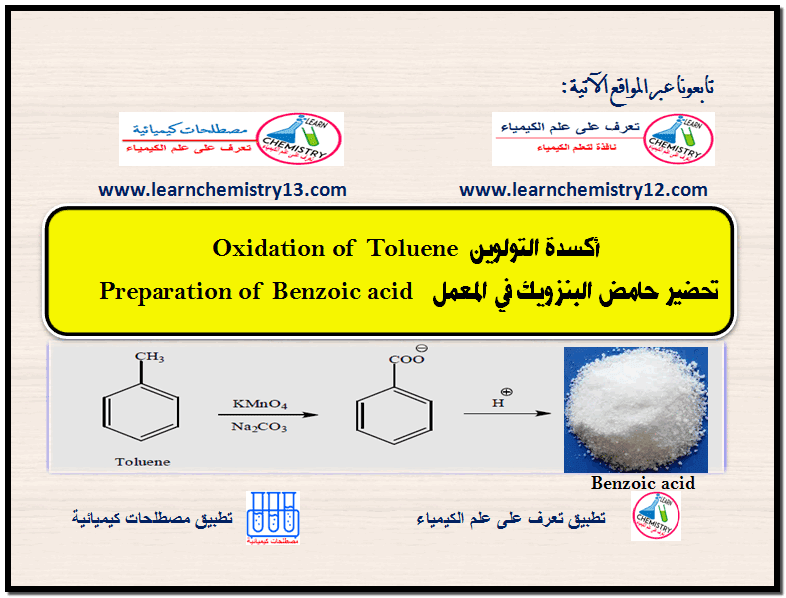
تجربة تحضير حمض البنزويك فى المعمل Preparation of Benzoic acid
أكسدة التولوين Oxidation of Toluene تحضير حامض البنزويك Preparation of Benzoic acid أولاً: الجزء النظري يمكن أكسدة المركبات الآروماتية…
أكمل القراءة » -
تحميل مذكرة/ أكثر من 1200 سؤال فى الكيمياء
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع مذكرة…
أكمل القراءة » -
مسائل محلولة على رتبة التفاعل Solved Problems On Reaction Order
يمكنك قراءة هذة الموضوعات قبل البدء فى حل المسائل حتى تكون على دراية كاملة بالقوانين المستخدمة فى حل هذة المسائل…
أكمل القراءة » -
طرق تعيين رتبة التفاعل Determination of Reaction Order
رتبة التفاعل Order of Reaction ** يعبر عن التغير في سرعة التفاعل مع التغير في تركيز المواد المتفاعلة بواسطة قانون فعل الكتلة.…
أكمل القراءة » -
تحميل كتاب الكيمياء التحليلية: المفاهيم الأساسية في التحليل التقليدي والآلي
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية في الروعة وهو…
أكمل القراءة » -
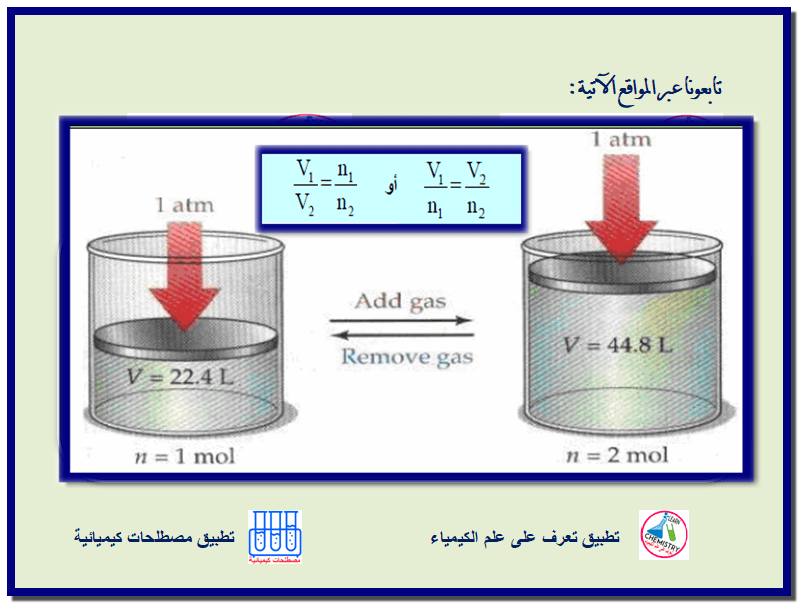
القانون العام للغازات المثالية + مسائل محلولة General Ideal Gas Law
استنتاج القانون العام للغازات المثالية 1) أخبرنا قانون شارل ومبدأ أفوجادرو بأن الحجم لغاز يتناسب طردياً مع : أ) درجة…
أكمل القراءة » -
معادلة القانون الموحد للغازات + مسائل محلولة The Combined Gas Law Equation
معادلة القانون الموحد للغازاتThe Combined Gas Law Equation حالة الغاز یمكن تحدیدھا بدلالة كل من كمیته (n) وحجمه (V) وضغطه…
أكمل القراءة » -
قانون جاي لوساك للغازات + مسائل محلولة (Gay-Lussac’s Law (P-T relationship
إذا سخن حجم معین من غاز في إناء مغلق ثابت الحجم(صلب مثلاً) فإن الحجم في هذه الحالة لا یتمدد،…
أكمل القراءة » -
قانون أفوجادرو وحساب الحجم المولاري Avogadro’s Law and the Molar Volume
نلاحظ أنه كلما أضفنا مزیداً من الغاز للبالونات أو لإطار سیارة فإنه تزداد أحجامھا، مما یدعونا للاستنتاج أن العوامل…
أكمل القراءة » -
قانون جاي- لوساك للحجوم المتحدة Gay-Lussac’s Law of Combining Volumes
قانون جاي- لوساك للحجوم المتحدة ** تستخدم المعادلة الكیمیائیة التي تدل على تفاعل أو إنتاج مادتین أو أكثر في الحالة…
أكمل القراءة » -
مسائل محلولة على قانون شارل للغازات Solved problems on Charle’s Law
نص قانون شارل أن علاقة حجم الغاز ودرجة الحرارة التى تم دراستها من قبل العالم الفرنسي تشارلز 1787م، وطورها…
أكمل القراءة » -
تحميل مذكرة عملى الكيمياء الحيوية
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم مذكرة عملية غاية في…
أكمل القراءة » -
مجموعات الجدول الدوري للعناصر Periodic table groups
الجدول الدوري يتكون الجدول الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods) وثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups). الدورات Periods – يتكون…
أكمل القراءة » -
وصف الجدول الدوري للعناصر Description of Periodic table
نشأة الجدول الدوري ** على الرغم من قيام عدد من العلماء بترتيب بعض أو جميع العناصر الكيميائية المعروفة في وقتهم…
أكمل القراءة » -
تحميل كتاب الكيمياء الفيزيائية العملية تأليف/ محمد مجدي واصل
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية في الروعة…
أكمل القراءة » -
تحميل كتاب الحركيات والكيمياء الكهربائية تأليف/ عبد الحميد الدباغ
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية…
أكمل القراءة » -
التوزيع الإلكتروني للذرة Electron Configuration of Atom
يتضح مما تقدم أن الأغلفة الرئيسية التي أشار إليها بور في نظريته الذرية تتكون من أغلفة ثانوية متنوعة من…
أكمل القراءة » -
حساب العدد الذري والعدد الكتلي ومتوسط الوزن الذري Calculation of Atomic Number, Mass Number and atomic weight
العدد الذري Atomic number ** هو عبارة عن عدد البروتونات الموجودة في نوية ذرة العنصر.ولما كانت ذرات العناصر المختلفة متعادلة كهربياً…
أكمل القراءة » -
مكونات الذرة ( البروتون Proton – النيترون Neutron – الإلكترون Electron )
(1) الذرة Atom ** هي عبارة عن جسيم متناهي في الصغر يحتوي على نواة وتكون معظم كتلة الذرة (massive nucleus). ** هذه…
أكمل القراءة » -
المخطط العملي للكشف عن الشقوق الحامضية في الأملاح البسيطة (Scheme for identification of acid radicals (anions
الكشف عن الشق الحامضي في الأملاح البسيطة Identification of acid radical ( anion) in sample salts الشق Radical عبارة عن…
أكمل القراءة »