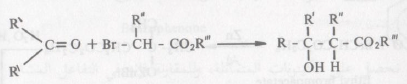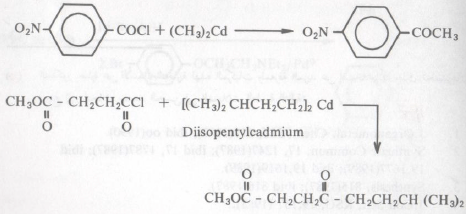المركبات العضوية الفلزية Organometallic Compounds
المركبات العضوية الفلزية Organometallic Compounds
ما هي المركبات العضوية الفلزية؟
– يمكن تعريف المركبات العضوية الفلزية بأنها المركبات التي تحتوي على رابطة بين الكربون والمعدن (C-M bond). وتعرف أيضاَ باللغة العربية بالمركبات العضومعدنية.
– لا يعتبر ميثوكسيد الصوديوم (NaOCH3) مركب عضومعدني وذلك لكون الرابطة فيه بين المعدن (الفلز) والأكسجين وليس بين المعدن والكربون.
– من أمثلة المعادن التي يمكن أن ترتبط بالكربون لتكون مركب عضو معدني (مركب عضوي فلزي) ما يلي:
- معادن المجموعة الأولى في الجدول الدوري مثل الليثيوم، الصوديوم، والبوتاسيوم والتي تسمى المعادن القلوية
- ومعادن المجموعة الثانية مثل المغنسيوم والكالسيوم والتي تسمى المعادن القلوية الأرضية.
- معادن المجموعة الثالثة مثل الألومنيوم ومعادن المجموعة الرابعة مثل الرصاص.
- المعادن الانتقالية مثل الحديد والنيكل والنحاس وغيرها
– ومن الأمثلة على هذه المركبات العضوية الفلزية ما يلي:
خواص المركبات العضوية الفلزية
– تختلف الخواص الكيميائية والفيزيائية للمركبات العضوية الفلزية على أساس مدى قطبية الرابطة بين الكربون والمعدن. حيث أنها قد تكون رابطة عالية القطبية (قريبة من الأيونية) كما في حالة ايثل الصوديوم (CH3CH2Na). وقد تكون تساهمية ضعيفة القطبية كما في رباعي ايثل الرصاص.
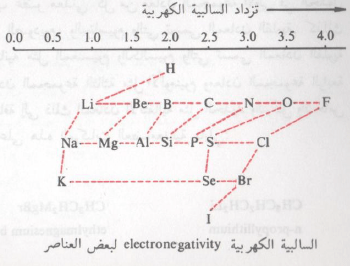
– وكلما زاد فرق السالبية الكهربية بين الكربون والمعدن كلما زادت قطبية الرابطة (أصبحت أكثر أيونية) وبالتالي يكون المركب العضومعدني أكثر نشاطاً (أقل استقراراً).
وبذلك فإنه يمكن استخدام مخطط السالبية الكهربية الآتي لمعرفة مدى قطبية الرابطة بين الكربون والمعدن في المركبات العضوية الفلزية. أو بمعنى آخر كلما زادت كهروايجابية المعدن كلما زادت قطبية الرابطة بين الكربون والمعدن.
وجدير بالذكر أن الكربون يأخذ القطب السالب والمعدن يأخذ القطب الموجب (Rδ- – Mδ+) وذلك لكون الكربون له سالبيه كهربية أعلى من المعدن وبذلك تميل السحابة الالكترونية تجاه الكربون.
– وعليه فإن فعالية المركبات العضوية الفلزية تكمن في الخاصية المميزة لصفة الربط بين الكربون والمعدن فهي تزداد فعالية كلما كانت هذه الرابطة أيونية.
– وبناء على ذلك فلم يكن غريباً عندما نقول أن مركبات الصوديوم والبوتاسيوم العضوية تعتبر في أول القائمة بالنسبة لفعالية مركبات هذه الطائفة فهي مركبات تتفاعل مع الماء بشدة وتتفاعل مع ثاني أكسيد الكربون، كما أنها مركبات غير متطايرة مثلها مثل الأملاح في هذه الخاصية ـ ويدعم هذا القول عدم ذوبانها في المذيبات غير القطبية.
– وبالمقارنة لمركبات الصوديوم والبوتاسيوم العضوية، نجد أن أملاح الزئبق العضوية مثل CH3)2Hg) تتخذ صفاتاً تختلف عن نظيرها في مركبات الصوديوم المطابقة فهي ضعيفة الفعالية وأكثر ثباتاً عند تعرضها للجو كما أنها أكثر تطايراً وتذوب في المذيبات غير القطبية.
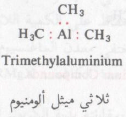
– هناك بعض المركبات التابعة لهذه الطائفة تكون بها الرابطة بين ذرة الكربون والعنصر هي «رابطة تساهمية جزئية» بمعنى آخر أن ذرة هذا العنصر لا يكتمل مدارها التكافؤي بالعدد اللازم من الالكترونات مثل:
حيث أن ذرة الألومنيوم في ثلاثي ميثيل الألومنيوم لها ستة الكترونات فقط في مدارها التكافؤي الخارجي.
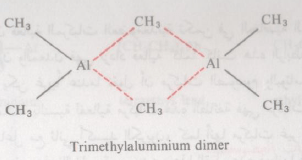
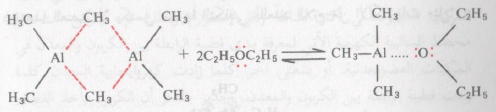
– هناك أيضاً القليل هذه المركبات توجد على هيئة متضاعفة (dimer) كما من ينضح لنا من تضاعف ثلاثي ميثل الألومنيوم
ويتصف ثلاثي ميثل الألومنيوم المتضاعف (وحتى المركبات المشابهة) بتكسره في محاليل المذيبات التي توجد بها أزواج من الالكترونات الحرة (غير المشتركة) مثل الايثر وذلك بالربط الآتي مع هذه الالكترونات كما يتضح من الآتي:
مركبات الماغنسيوم العضوية Organomagnesium Compounds
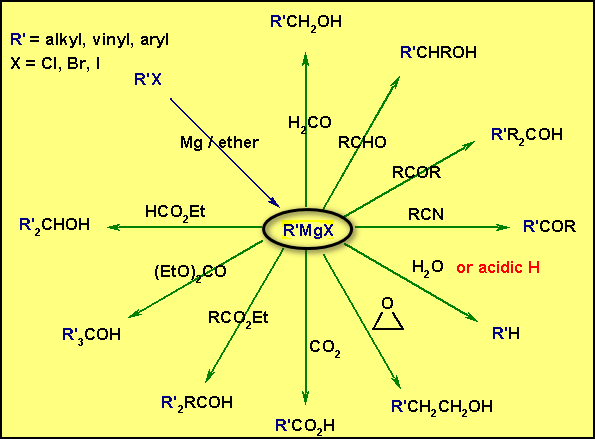
– إن أهم مركبات المغنسيوم العضوية هي هاليدات المغنسيوم العضوية أو ما تسمى بكواشف جرينارد (Grignard reagents)
– بالطبع أن كواشف جرينارد لم تكن جديدة علينا وقد سمعنا بها في كثير من التفاعلات في الكيمياء العضوية ويسمى بهذا الاسم نسبة إلى مكتشفه فيكتور جرينارد).
–الصيغة العامة لمركب جرينارد هي (RMgX) حيث ترمز (X) للهالوجين وأما (R) فقد تكون مجموعة ألكيلية (سلسلة كربونية مفتوحة مشبعة أو غير مشبعة) أو قد تكون مجموعة أريلية Aryl group.
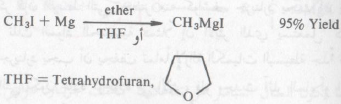
– يحضر كاشف جرينارد من تفاعل الهاليد العضوي مع حبيبات الماغنسيوم في وجود الأيثر الجاف وتختلف الهاليدات العضوية اختلافاً بيناً في سرعة اتحادها مع المغنسيوم ـ فقد تتفاعل هاليدات الألكيل مع الماغنسيوم في الأيثر الجاف بسرعة أكبر من تفاعل الهاليدات الأروماتية.
وقد يكون التفاعل عنيفاً في بدايته ولذا فإنه يلزم التبريد من آن إلى آخر أثناء فترة التحضير حتى يمكن الحفاظ على الكمية اللازمة من الايثر (يغلي عند درجة ٣٥°م)، وباستمرار التفاعل يختفي معدن الماغنسيوم ويعرف حينئذ المحلول الناتج بكاشف جرينارد وفعالية هذا الكاشف RMgX تنشأ الفرق الكبير في السالبية الكهربية للماغنسيوم بمقارنته بذرة الكربون الرابطة معه (Rδ- : Mgδ+ – X )
مركبات الليثيوم والصوديوم Organo-lithium and Organo-sodium Compounds
إن هذه المركبات تسلك في تفاعلاتها نفس سلوك مركبات جرينارد، إلا أنها أكثر فاعلية من المركبات الأخيرة فهي:
- مركبات حساسة جداً لأكسجين الهواء والرطوبة.
- تتفاعل مع الأيثرات والهاليدات العضوية مركبات الكربونيل، ومركبات النيتريلات.
- لسهولة تحضير مركبات الليثيوم العضوية وكذلك سهولة ذوبانها في الكثير من المذيبات العضوية فإنها أنفع المركبات المعدنية لعناصر المجموعة الأولى في الجدول الدوري في أغراض التحضير في الكيمياء العضوية.
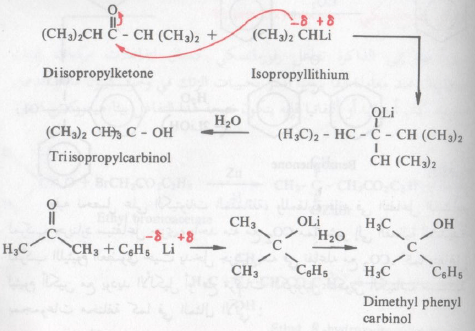
– وكما ذكرنا أنفاً أنها أكثر فاعلية من مركبات جرينارد وهذه الفعالية الشديدة تجاه مجموعة الكربونيل ومجموعة النيتريل تؤدي إلى نشوء محاصيل جيدة من نواتج هذه التفاعلات بالمقارنة إلى نفس التفاعلات المشابهة باستخدام مركبات جرينارد . تأخذ على سبيل المثال :
فالكحول السابق لا يمكن أن يحضر باستخدام کاشف جرينارد المطابق وربما يرجع ذلك إلى الحجم الكبير لهذا الكاشف مما يمنع وصوله إلى (مهاجمة) مجموعة كربونيل الكيتون المعاق فراغياً (Sterically hindered)
أيضاً تتفاعل مركبات الليثيوم مع هاليدات الأريل أو هاليدات الألكينايل (alkenyl halide) في حين أن مركبات جرينارد لا تتفاعل معها بسهولة وبالطبع فإن هذا التفاعل له القيمة الكبرى لاسيما في حالة وجود الكلوريدات فقط وعدم توفر الهاليدات الأريلية المطابقة الأخرى:
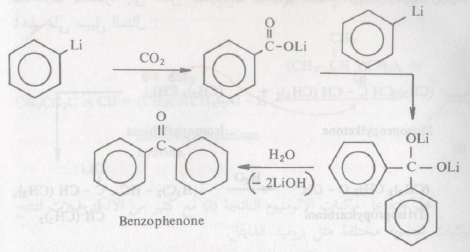
كما وتتفاعل مركبات الليثيوم العضوية مع ثاني أكسيد الكربون:
وفيه نحصل على الكيتونات المتماثلة، وللمقارنة فإنه في التفاعل المشابه لمركب جرينارد سيتفاعل جزئ واحد منه مع CO2 مما يشير إلى الفعالية الشديدة لمركب الليثيوم العضوي حيث يدخل جزيئين منه في تفاعله مع CO2، كما يتفاعل ليثيوم ألكين مع يوديد الألكيل أو مع مركبات الكربونيل لتكوين ألكينات مستبدلة بمجموعات مختلفة كما في المثال الآتي :
مركبات الزنك العضوية Orgamo Zinc Compounds
– هي أول من عُرفت من المركبات العضوية الفلزية في عام ١٨٤٩م بواسطة فرانك لاند Frankland. عندما حاول العالم فرانك لاند تحضير جذر الإيثيل C2H5 من تسخين يوديد الأيثيل مع الزنك.
– ثنائي ألكيل الزنك سوائل ملتهبة سهلة التطاير وهي أقل فاعلية من کواشف جرینیارد.
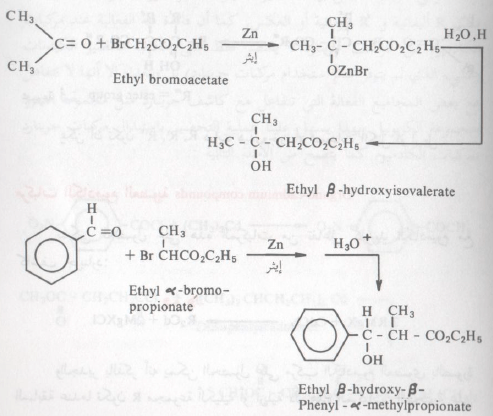
تفاعل رفورماتسكي: Reformatsky reaction
تفاعل رفورماتسكي هو مثال لتفاعلات مركبات الزنك العضوية. عند معاملة ألفا برومو استر بحبيبات الزنك في وجود كيتون ما أو ألدهيد ما سواء كان أرومانيا أو أليفاتياً فإنه يتكون نتيجة هذا التفاعل بيتا هيدروكسي استر.
ففي الأمثلة السابقة الذكر فإن الألفا برومو استر يتفاعل مع الزنك في الايثر (كمذيب). حيث يتكون مركب الزنك العضوي المطابق والذي بدوره يهاجم مجموعة الكربونيل في الألدهيد أو الكيتون،
كلاً من تكوين وتفاعل الزنك شبيه جداً بتكوين وتفاعل مركبات جرينارد. بيد أن استعمال الزنك بدل الماغنسيوم يؤدي إلى تكوين مركبات عضومعدنية أقل فاعلية من مركبات جرينارد. ويتضح هذا من الأمثلة الآنفة الذكر حيث أن مركب الزنك العضوي عندما يتكون يهاجم مجموعة الكربونيل. ولا يتفاعل مع مجموعة الاستر ولهذا السبب تعتبر مركبات الزنك أبرع الطرق لتحضير بيتا هيدروكسي استرات –hydroxyestersβ
– والجدير بالذكر أن تفاعل رفورماتسكي لا يتم إلا مع الاسترات المحتوية على بروم في الموضع ألفا. الشيء الذي يجعله من الضرورة بمكان أن تكون نواتجه هي مركبات البيتا هيدروكسي استرات
مجموعة أستر R” = ester group
يمكن أن تكون “R, R‵, R ذرات هيدروجين أو مجموعات ألكيل أو أريل
مركبات الكادميوم العضوية Organo-cadmium compounds
– يمكن الحصول على هذه المركبات من تفاعل كلوريد الكادميوم مع کاشف جرينارد:
– والجدير بالذكر أنه يمكن الحصول على مركب الكادميوم العضوي بالصورة السابقة عندما تكون R مجموعة ألكيلية أو أريلية. لأن هذه المركبات المحتوية على المجاميع السابقة أكثر ثباتاً من مركبات الكادميوم الأخرى التي تشمل مجاميع الكيلية غير مشبعة.
– بالرغم من مركبات الكادميوم تقوم بنفس تفاعلات جرينارد إلا أنها أقل فاعلية من الكواشف الأخيرة. ولعل هذا يتضح من تفاعل مركب كلوريدات الحموض حيث ينتج من جراء ذلك المركب الكيتوني المطابق دون أية كمية محسوسة من الكحول الثالثي.
ـ بعكس تفاعلات مركبات جرينارد المشابهة ـ ويرجع ذلك إلى نقصان الفعالية عند مركبات الكادميوم بالمقارنة لمركبات جرينارد:
– وهي طريقة لا بأس بها لتحضير الكيتونات سواء أرومانية أو أليفاتية وعندما تكون R أليفاتية و ‵R أروماتية أو العكس.
– كما أن فائدة قلة الفعالية عند مركبات الكادميوم عن كواشف جرينارد لا يقتصر فقط على إمكانية تحضير الكيتونات. (الشيء الذي لم يتوفر عند استخدام مركبات جرينارد). بل ويتعداه إلا أنها لا تتفاعل مع بعض المجاميع الفعالة التي تتفاعل مع كاشف جرينارد مثل مجموعة النيترو ومجموعة الكربونيل. وبهذا يسهل علينا عملية التحضير باستبدال مركبات جرينارد بمركبات الكادميوم الأمثلة التالية :
المراجع: الكيمياء العضوية / د.حسن محمد الحازمي / الجزء الثاني