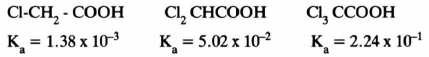العوامل المؤثرة على قوة الأحماض والقواعد في المركبات العضوية
العوامل المؤثرة على قوة الأحماض والقواعد في المركبات العضوية
– تتأثر قوة الأحماض والقواعد بعوامل أهمها المذيب، الفعل التحريضي، وتأثير الطنين.
– كما تؤثر الإذابة للمذيب على تفكك كل من الأحماض والقواعد فنجد أن المذيبات القطبية مثل الماء تزيد من قوة الأحماض والقواعد.
– أما تأثير الفعل التحريضي وتأثير الطنين فها عاملان أساسيان في تحديد قوة كل من الأحماض والقواعد إذ أنها يحددان تركيب المادة العضوية.
أولاً/ تأثير الفعل التحريضي Inductive effect على قوة الأحماض والقواعد
– لقد أصبح مألوفاً لدى دارس الكيمياء العضوية في المراحل المتقدمة في الجامعة أن المجاميع الألكيلية تكون قادرة على منح الإلكترونات أكثر مما تعمل ذرة الهيدروجين.
– ولكي تكون الفكرة واضحة فإن عملية منح الإلكترونات هذه يمكن فهمها بشكل أفضل من مقارنة أشكال المدارات Orbitals لذرة الكربون المهجنة sp3 فمن المعروف أن مدار (s) يأخذ شكلاً كروياً مما يجعل مركز الشحن السالبة منطبقاً مع مركز الشحن الموجبة لنواة الذرة كما أن شكل مدار التهجين sp3 يؤدي إلى جعل السحابة الإلكترونية الناتجة عن الاتحاد تكون في اتجاه الذرة المتحد بها.
– وهذا يجعل المجموعة الألكيلية قادرة على إعطاء إلكترونات أكثر من ذرة الهيدروجين، للذرة المتصلة بها. وسوف تكون هذه الذرة المتصلة بالمجموعة الألكيلية متخمة بالإلكترونات أكثر منها فيما لو كانت متصلة مع الهيدروجين وعليه يكون تأثير الفعل التحريضي في هذه الحالة مقللاً للحمضية وزيادة القلوية للمادة العضوية.
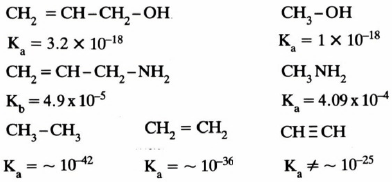
– وتبين الدراسات العملية تأثير الفعل التحريضي في الأمثلة التالية:

فمن الملاحظ في الأمثلة السابقة أن حمضية الميثانول أقل من حمضية الماء نتيجة الفعل التحريضي الموجب لمجموعة الميثيل والتي تم استبدالها بدلاً من ذرة هيدروجين في الماء كذلك فإن قاعدية ميثيل أمين أكبر من قاعدية الأمونيا لنفس السبب.
ثانياً/ تأثير التهجين Hybridization على قوة الأحماض والقواعد
– وبالتسلسل في الموضوع فإن الشيء المعروف عن الكترونات (s) أنها تكون قريبة من نواة الذرة موجبة الشحنة أكثر من إلكترونات (p) وعلى هذا الأساس فإن المدارات المهجنة من نوع s 50% ) sp ) أكثر سالبية من مدار sp2 (s 33%) والذي بدوره أكثر سالبيه من مدار sp3 (25٪ s ).
ويمكن التأكد من صحة هذا القول بمقارنة قوة الحامضية والقاعدية لبعض الكحولات والأمينات المشبعة وغير المشبعة التالية:
ثالثاً/ تأثير الطنين (الرنين) Resonance على قوة الأحماض والقواعد
– يعتبر تأثير الطنين من أهم العوامل المؤثرة على قوة الأحماض والقواعد.
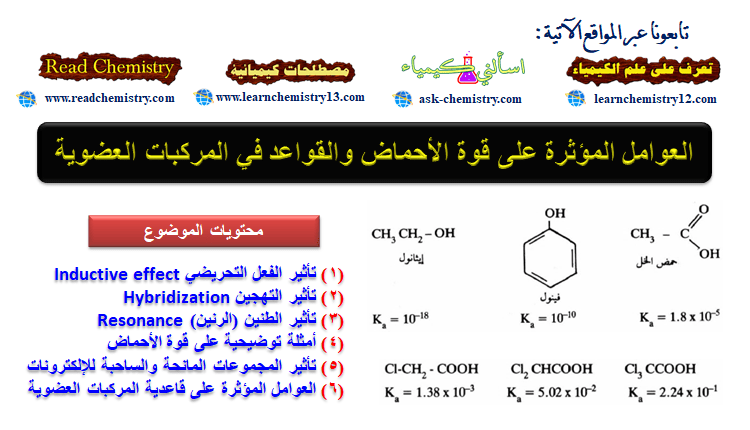
– فعند مقارنة حمضية الكحولات والفينولات مع حمضية الأحماض الكربوكسيلية يتعجب المرء لماذا تعطي مجموعة (OH) في مجموعة الكربوكسيل للأحماض بروتون بسهولة أكثر من (OH) في الكحولات والفينولات.
– فعلى سبيل المثال نجد أن حمض الخل أقوى مائة ألف مرة من الفينول. وكذلك الفينول أقوى مائة مليون مرة من الإيثانول.
– ويرجع السبب كذلك أي كحول مهما كان نوعه أقوى حمضية من الفينول نفسه. أي أنه تبقى الأحماض متصلة فيها مجموعة OH بمجموعة ألكيلية مشبعة (3sp) بينما تتصل مجموعة OH في الفينول بالحلقة العطرية بذرة كربون sp2 وكذلك الحال تكون OH في الأحماض الكربوكسيلية متصلة بذرة كربون sp2 (الكربوكسيل).
– يتبين من الأمثلة أعلاه أن الفرق في الحامضية بين الأمثلة الثلاثة كبير جداً يوحي بأن الفعل التحريضي ليس العامل الأساسي في هذا الفرق الواضح في الحامضية وفي الحقيقة فإن تأثير الطنين والفعل التحريضي والتهجين تلعب مجتمعة دوراً أساسياً في هذه الاختلافات.
رابعاً/ أمثلة توضيحية على قوة الأحماض
(1) الأحماض الكربوكسيلية أكثر حمضية من الفينولات والكحولات
– ففي أيون الكربوكسيل نجد أن الشحنة السالبة موزعة بالتساوي بين ذرتي الأكسجين نتيجـة للطنـيـن. وهـذا بدوره سيكون المسؤول عن ثبات أيون الكـربـوكسيل Carboxylate ion وسوف يسهل فقدان أيون الهيدروجين من مجموعة الكربوكسيل ويزيد من الحامضية.
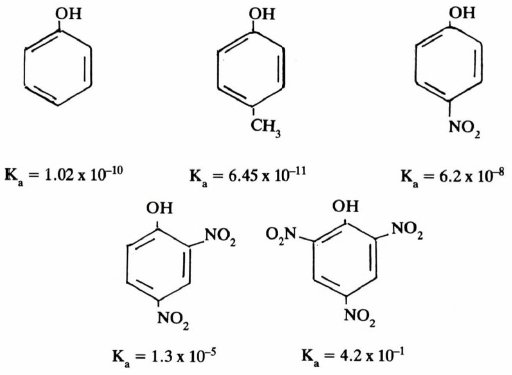
(2) الفينولات أكثر حمضية من الكحولات
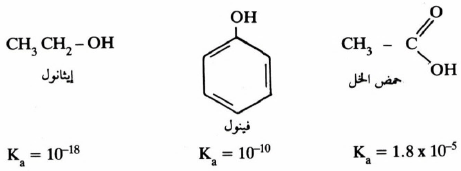
– يحتوي الفينول على مجموعة OH متصلة بالحلقة العطرية وتنشأ فعالية الفينول من تداخل تأثير المجموعة الهيدروكسيلية مع الحلقة العطرية . لقد عرفنا أن مبدأ التأثير التحريضي الناتج عن ذرة كربون sp2 يكون أكثر كهروسلبية من ذرة الكربون sp3 وهذا يوحي بأن حمضية الفينولات أقوى من حمضية الكحولات . إلا أن دراسة أشكال الطنين في أيون الفينوكسيد Phenoxide ion توضح أن إلكترونات ذرة الأكسجين تكون متناوية مع الروابط المضاعفة لحلقة البنزين:
أشكال الطنين في أيون الفينوكسيـد
وهذه الأشكال لأيون الفينوكسيد توحي بأن هذا الأيون أكثر ثباتاً مما يتوقع في غياب تأثير الطنين .
وللمقارنة فإن أيون الألكوكسيد Alkoxide ion يتعذر كتابة أكثر من شكل واحد له لغياب ظاهرة الطنين ولهذا السبب يكون انفصال أيون هيدروجين من مجموعة OH في الفينولات أسهل من انفصال أيون هيدروجين من مجموعة OH في الكحولات مما يجعل الفينولات أكثر حمضية من الكحولات.
(3) الأحماض الكربوكسيلية أقوى حمضية من الفينولات والفينولات أقوى حمضية من الكحولات
– لقد ذكرنا سابقاً أن التأثير التحريضي للمجاميع الألكيلية هو السبب في اختلاف حمضية الماء والكحولات وعلى ضوء ذلك فإن تنوع المجاميع الاستبدالية في الحمض الكربوكسيلي والفينول سيغير من حمضيته وعلى أية حال فإن هذا التغير في الحمضية سيكون بسيطاً جدا.
– من النادر أن نجـد أي فينول، مهما كانت المجاميع الاستبدالية التي يحملها، أقوى حمضية من الحمض الكربوكسيلي.
– من النادر أن نجد أي كحول مهما كان نوعه أقوى حمضية من الفينول نفسه.
– أي أنه تبقى الأحماض الكربوكسيلية أقوى حمضية من الفينولات وهذه أقوى حمضية من الكحولات.
(4) المجاميع الألكيلية تضعف من حمضية الحمض
– إن أبسط الأحماض الكربوكسيلية المشبعة هو حمض الفورميك. والذي تكون فيه المجموعة المتصلة بمجموعة الكربوكسيل عبارة عن ذرة هيدروجين. ويليه حمض الخل والذي ترتبط فيه مجموعة مثيل بالمجموعة الكربوكسيلية .
– فتلاحظ من الأمثلة في الجدول التالي أن الفعل التحريضي للمجاميع الألكيلية يضعف من حمضية الحمض .
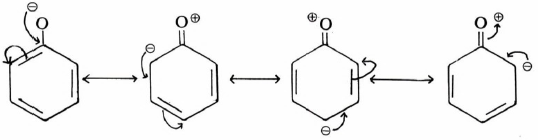
(5) الأحماض الكربوكسيلية العطرية أكثر حمضية من الأحماض الكربوكسيلية المشبعة
تختلف الأحماض الكربوكسيلية العطرية عن الأحماض الكربوكسيلية المشبعة في كون الأولى يتوفر فيها ظاهرة الطنين بشكل أكبر إضافة إلى أن المجموعة الكربوكسيلية تكون مرتبطة بذرة كربون sp2 فنجد أن حمض البنزويك أقوى من حمض الخل.
– كما أن وجود مجاميع مانحة للإلكترونات على الحلقة العطرية من شأنه إضعاف الحمضية كما في الأمثلة التالية:
خامساً/ تأثير المجموعات المانحة والساحبة للإلكترونات على الحامضية
– وجود مجاميع مانحة للإلكترونات من شأنه إضعاف الحمضية.
– إن إدخال مجاميع ساحبة للإلكترونات يؤدي إلى زيادة قوة الأحماض وهذا ناتج عن التأثير التحريضي لهذه المجاميع
– كلما زاد عدد هذه المجاميع الساحبة للإلكترونات كلما كان التأثير على الحامضية أكثر وضوحاً كما في الأمثلة التالية:
– تتأثر أيضا حمضية الفينولات بالمجاميع المتصلة بالحلقة العطرية إذا كانت مانحة للإلكترونات أو ساحبة لها. كما يتضح من سرد الأمثلة التالية :
سادساً/ العوامل المؤثرة على قاعدية المركبات العضوية
يمكن تطبيق المناقشة نفسها على قوة القاعدية للمركبات العضوية حيث تتأثر القاعدية بما يلي:
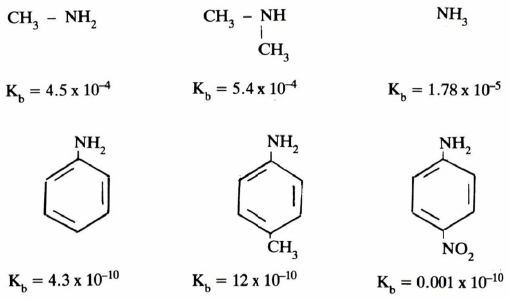
(1) فعل التأثير التحريضي
فنجد أن الأمينات المشبعة تكون أكثر قاعدية من الأمونيا نظراً للفعل التحريضي لمجموعات الألكيل. بينمـا نجـد أن الأمينات العطرية أقل قاعدية من الأمونيا نظراً لأن الزوج الإلكتروني على ذرة النيتروجين، والمسؤول عن قاعدية الأمينات، يدخل في طنين مع الحلقة العطرية إضافة إلى أن المجموعة الأمينية تكون مرتبطة مع ذرة كربون sp2.
(2) المجموعات المانحة والساحبة للإلكترونات
وتتأثر القاعدية كذلك بالمجاميع المرتبطة على الحلقة العطرية. فتزداد عند ارتباط مجاميع مانحة للإلكترونات وتقل عند وجود مجاميع ساحبة للإلكترونات كما توضح الأمثلة التالية:
(3) الرنين (الطنين)
وتضعف القاعدية بشكل ملحوظ عند وجود شحنة موجبة على ذرة نيتروجين المجموعة الأمينية. كما يحدث عند إضافة حمض معدني على محلول الأمين إذ أن هذا يعني غياب الزوج الإلكتروني المسؤول عن القاعدية.
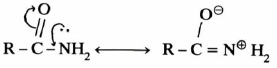
ولهذا السبب فإن الأميدات تكون أقل قاعدية من الأمينات المطابقة. نظراً لأن تأثير الطنين يؤدي إلى ظهور شحنة موجبة على ذرة نيتروجين المجموعة الأمينية كما توضح أشكال الطنين التالية:
تأثير الطنين في الأميدات
المراجع:
كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م