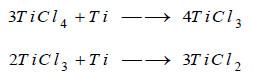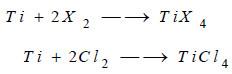معلومات هامة جداً عن عنصر التيتانيوم Titanium
ما هو عنصر التيتانيوم Titanium؟
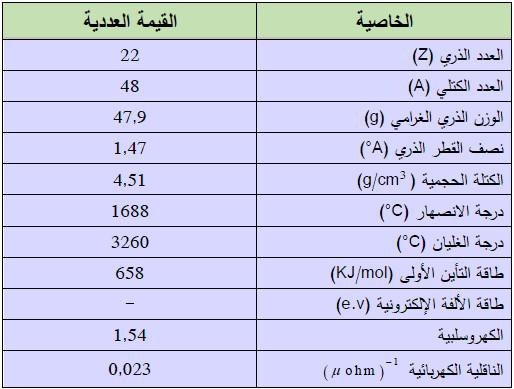
التيتانيوم عنصر من عناصر الجدول الدوري: العدد الذري = 22، العدد الكتلي = 48
– يرمز لعنصر السكانديــوم له بالرمز: 48Ti22
– التوزيع الإلكتروني له : Ar]18 4s2 3d2]
– عبارة عن معدن فضي اللون لمَاع ومقاوم للتأكل.
– كثافته منخفضـة.
– يعد التيتانيوم من العناصر القاسية وهو شبيه ببعض أنواع الفولاذ من حيث قساوته لكنه أخف بمقدار 45%.
– لا يتمتع بخاصية مغناطيسية ملحوظة
– ضعيف الناقلية الحرارية والكهربائية.
– الخواص العامة لعنصر التيتانيوم يتم توضيحه كما هو بالجدول التالي:
اكتشافه ووجوده في الطبيعة Discovery of Titanium
– اكتشف التيتانيوم عام 1791م من قبل الكيميائي البريطاني (Gregor).
– اشتق اسمه من الأسطورة الإغريقية، حيث Titans آلهة عملاقة و Gaia أبناء الأرض و Uranus السماء إشارة إلى المقاومة الكبيرة لهذا المعدن.
– يظهر التيتانيـوم بشكل طبيعي كمكون لبعض الرسوبيات الفلزية، ويرتبط دائما الطبيعة.
– يأتي ترتيبه التاسع من حيث وفرته بين العناصر في القشرة الأرضية والسابع بين المعادن.
– يتوزع بشكل واسع في فلزات القشرة الأرضية.
– ومن أهم فلزاته ذات المردود الاقتصادي نذكر: الروتيل TiO2 والايلمنيت FeTiO3 رغم أنهما لا يتواجدان بتراكيز معتبرة.
– يوجـد التيتانيـوم في كافة الأشياء الحية تقريباً وفي الصخور والتربة والمياه.
– ومن أهم مركباته الأكثر وجوداً أكسيد التيتانيوم ومركب رباعي كلوريد التيتانيوم وثلاثي أكسيد التيتانيـوم.
تحضير التيتانيوم Preparation of Titanium
(أ) الاختزال الحراري لرابع كلوريد التيتانيوم TiCl4
يلجأ في الصناعة للحصول على معدن التيتانيوم الصافي إلى طريقة الاختزال الحراري لرابع كلوريد التيتانيوم TiCl4 باستخدام معدن ما كمعدن الماغنسيوم Mg كالتالي:
(1) يتم إمرار تيار من غاز الكلور على الإيلمنيت أو الروتيل المسـخن مع الكربون بدرجة 900مo فيتشكل بخار رابع كلوريد التيتانيوم الذي يتحول إلى سائل عند درجة الحرارة 136°م.
(2) يقطر السائل تقطيراً مجزئاً للحصول على TiCl4 النقي.
(3) يختزل بخار رابع كلوريد التيتانيـوم تحت الضغط الجوي بواسطة المعدن Mg المنصهر بدرجة حرارة 800مo بجو من الأرجون إلى معدن التيتانيـوم كما هو موضح في المعادلة:
(4) يستخلص كلوريد المغنيزيوم MgCl2 المنصهر والمتبقي من وسط التفاعل عندما تبلغ نسبة معدن Mg المستهلك 60% تحاشياً لتفاعل ثانوي لاحق قد يحصل كما في المعادلتين:
(5) يتم هذا الاستخلاص بتبريد وسط التفاعل وسحق الكتلة الصلبة المتشكلة ميكانيكياً ثم غسل مسحوق الكتلة بحمض مخفف.
(6) يفصـل معدن المغنيزيوم وكلوريد المغنيزيوم عن معدن التيتانيـوم من وسـط التفاعل بعد ذلك بالتقطير تحت ضغط منخفض.
(ب) اختزال رابع كلوريد التيتانيوم بالصوديوم المنصهر
يمكن كذلك الحصول على معدن التيتانيوم باختزال رابع كلوريد التيتانيوم بالصوديوم المنصهر كما في المعادلة:
تفاعلات التيتانيوم Chemical properties of Titanium
– يعتبر عنصـر التيتانيـوم عنصـراً خاملاً كيميائياً عند درجة الحرارة العادية ونشيط عند الدرجات المرتفعة، لذا يتفاعل مع المواد التالية عند الدرجات المرتفعة من الحرارة:
(1) تفاعل التيتانيوم مع الأكسجين
يتفاعل التيتانيـوم مع الأكسجين أو الهواء حسب التفاعل التالي:
الأكسيد الناتج عبارة عن مادة بيضاء اللون، صعبة الانحلال في ماء والحموض والأسس الممددة.
(2) التفاعل مع الهالوجينات
يتفاعل التيتانيـوم مع الهالوجينات وفق التفاعل التالي:
(3) التفاعل مع الماء
يتفاعل التيتانيوم مع الماء ويتشكل أكسيد التيتانيوم مع انطلاق غاز الهيدروجين حـسب التفاعل التالي:
يتفاعل كذلك مع الماء الأكسجيني مشكلاً فوق أكسيد التيتانيـوم وفق التفاعل التالي:
(4) التفاعل مع الكربون
يتحد التيتانيـوم مع الكربون مكونا TiC حسب التفاعل التالي:
(5) التفاعل مع السليسيوم
يتحد التيتانيـوم مع السليسيوم وذلك حسب التفاعل التالي:
استخدامات التيتانيوم Uses of Titanium
(1) يستخدم التيتانيـوم في خلائط عديد من الحديد والألمنيوم والفناديوم وعناصر أخرى:
- لإنتاج مواد قوية خفيفة في الصناعة الجوية (المحركات النفاثة والصواريخ وفي الصناعات العسكرية).
- العمليات الصناعية (المواد الكيميائية والبتروكيماويات ومحطات إزالة الملوحة وصناعة الورق).
- زراعة الأسنان
- أدوات الرياضـة
- المجوهرات
- الهواتف النقالة
- تطبيقات أخرى.
(2) يستخدم حوالي 95% من فلزات التيتانيـوم لتحول إلى أكسيد التيتانيـوم لاستخدامه في صناعة الورق والدهانات ومعجون الأسنان والبلاستيك.
(3) يستخدم أيضاً في الإسمنت.
(4) ولأن مسحوق أكسيد التيتانيـوم غير فعال ولا ينفذ الضوء من خلاله كيميائياً، ولذلك يستخدم في كثير من الأدوات البلاستيكية المستخدمة في المنازل لإعطائها اللون الأبيض.
(5) تستخدم قضبان التيتانيـوم في عملية في عمليات لحام المبادلات الحرارية والصهاريج والصمامات المستخدمة في الصناعات الكيميائية، وكيمياء النفط بسبب مقاومته للتأكل.
(6) كما يستخدم في سيارات ومحركات السباق حيث تكون قلة الوزن ومتانة التجهيزات مهمتين في مثل هذه الحالات.
(7) وفي المجال الطبي يستخدم التيتانيـوم في سـلسـلة كاملة من التطبيقات الطبية بما في ذلك أدوات الجراحة والزرع التي يمكن أن تبقى في الجسم لمدة 20 عاما، ويعود السبب في هذه الاستخدامات إلى عدم سميته، وميزاته الحيوية المناسبة.
تأثير التيتانيوم على جسم الإنسان
– ليس للتيتانيـوم أية سمية حتى عند التراكيز العالية.
– لا يلعب التيتانيـوم أي دور طبيعي داخل جسم الإنسـان.
– ويقدر ما يتناول مع الطعام بـ 0.8 مليغرام من التيتانيوم يومياً، لكن غالبيتها تمر دون أن يمتصها الجسم، غير أنه توجد إمكانية للتراكم الحيوي في النسج الحاوية على السليكا.
المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- العناصر الانتقالية – كتاب الصف الثالث الثانوى – جمهورية مصر العربية 2021