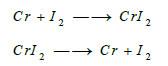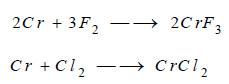الكروم Chromium – معلومات هامة جداً عن عنصر الكروم
ما هو عنصر الكروم Chromium؟
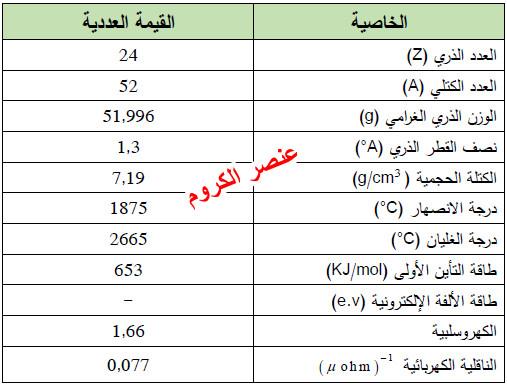
– الكروم عنصر من عناصر الجدول الدوري: العدد الذري = 24، العدد الكتلي = 52
– يرمز لعنصر الكروم له بالرمز: 52Cr24
– التوزيع الإلكتروني له: Ar]18 4s1 3d5]
– الكروم عبارة عن معدن رمادي فضي.
– يوجد بشكل طبيعي في الصخور والتربة والنباتات والحيوانات وكذلك في الإنسان.
– يوجد متحداً مع عناصر أخرى في صيغة أملاح الكروم التي ينحل بعضها في الماء.
– نادراً ما يوجد في الطبيعة على هيئة معدن نقي.
– لا يتبخر الكروم ولكن وجوده في الهواء يمكن أن يكون على شكل جسيمات.
– نظراً لكونه عنصراً فهو لا يتجزأ ولا يمكن إتلافه.
– وفيما يلي الخواص العامة لعنصر الكروم:
اكتشافه ووجوده في الطبيعة Discovery of Chromium
– عزل الكروم عام 1870م من قبل Vauquelin في فرنسـا.
– اشتــق الكروم اسـمه من اليونانية Kröma بمعنى لون.
– أطلق عليه هذا الاسم من طرف Fourcroy و HaÜy نظراً للألوان الكثيرة لمركبات الكروم.
– يشكل معدن الكروم 0,02% من وزن القشرة الأرضية، وهو من العناصر المهمة، إذ يوجد في كل مكان.
– للكروم ثلاث حالات في الطبيعة: فلز معدني، كروم ثلاثي التكافؤ وسداسي التكافؤ.
– يوجد الكروم ثلاثي التكافؤ بشكل طبيعي في كثير من الخضــار الطازجة والفواكه واللحم والحبوب والخميرة الطازجة.
– الكـروم الثلاثي غير قابل للانحلال نسبياً لذا فهو الشكل الأكثر شيوعاً على سطح التربة حيث تكون عمليات الأكسدة (التي تحول الكروم السـداسـي من الحالة السداسية إلى الثلاثية) هي الأكثر حدوثاً.
– يوجد الكـروم السداسي أيضاً بشكل طبيعي وبشكل ملحوظ في الحالات المشبعة.
– الكـروم السداسي ذواب نسبياً ويمكنه التغلغل بسهولة في التربة والوصول إلى المياه الجوفية التحتية.
– تكون تراكيز الكـروم في الماء والهواء ضـعيفة جداً، تتراوح في الهواء عادة بين 0.01 و 0.03 ميكروغرام في المتر المكعب.
– من أهم مركباته:
- خام الكروميت (Cr2O3.FeO)FeCr2O3
- خام كرومات الرصاص ((PbCrO4 الذي يعتبر أقل أهمية من فلز الكروميت.
تحضير الكروم Preparation of Chromium
تعتمد الصناعة عند تحضير الكروم طريقتين:
- على شكل سبائك صناعية مهمة (حديد – كروم).
- على شكل معدن نقي صاف.
– نحصل على الشكل الأول بالاختزال المباشر لخام الكروميـت Cr2O3.FeO بالفرن العالي الكهربائي (خليط Fe – Cr – C) أو بطريقة الألمنيوم الحراري.
– وللحصـول على الشكل الثاني المعدني النقي يجب القيام بعدة عمليات كيميائية تجرى على خام الكروميت وأثناءها نحصـل على مركبات مختلفة للكروم، وهذه العمليات هي:
العمليات الكيميائية التي تجرى على خام الكروميت
(1) طحن خام الكروميت FeCr2O4 ثم أكســتـه بالهواء في الدرجة 1200مo بفرن دوار.
بوجود كربونات الصوديوم Na2CO3 وأكسيد الكالسيوم ( (CaOالذي يمنع التصاق المزيج المنصهر بجدران الفرن الكهربائي حيث يتم أثناءها التفاعل التالي:
يعتبر أكسيد الحديد (Fe2O3) أحد شوائب التفاعل. كما يتفاعل الألومين (Al2O3) والسيليكا (SiO2)، فنحصل على الألومينات ((AlO2– أو سيليكات الصوديوم.
(2) غسـل الكتلة المتشكلة بالطريقة المعروفة وإذابة الكرومات والكربونات الزائدة مع قليل من الألومينات والسيليكات المرافقة. يرشح المجموع لفصـل جميع المركبات غير الذوابة كأكسيد الحديد والسيليكات وأكسيد الكالسيوم والكروميت غير المتفاعلة.
(3) معالجة المحلول الناتج بحمض الكبريتيك H2SO4 الذي يرسـب السيليكا والألومين ويفكك كربونات الصوديوم ويحول الكرومات إلى ثاني كرومات –Cr2O72 كما في المعادلة:
يرشح السائل الحاصل لفصل رواسب السيليكا والألومين.
(4) يبخر سـائل ثاني كرومات الكبريتات لحد معين لتترسـب كبريتات الصوديوم كناتج صـناعي ثانوي، أما السـائل المتبقي فيحتوي على ثاني كرومات وقليلاً من الكبريتات لذلك نعالجه بالطريقة التالية:
للحصول على مركبات الكـروم يجب إبعاد كبريتات الصوديوم كلياً، وعليه يجب تركيز محلول ثاني كرومات الصوديوم ثم إضافة محلول مشبع من كلوريد البوتاسيوم له.
بما أن ثاني كرومات البوتاسيوم قليلة الذوبان في وسـط التفاعل فإنها تنفصـل بسهولة.
إن الحصـول على معدن الكـروم النقي جدا عملية صعبة للغاية ولم تستطع الصناعة الوصول إليه، حتى وإن كانت الطريقة المتبعة طريقة المنطقة المنصهرة، وذلك لأن لمعدن الكـروم ضغطاً بخارياً عالياً عند نقطة انصهاره، ولكن الطريقة المقبولة (نوعاً ما) في الصناعة لتنقية الكـروم هي – طريقة (فان اركل) التي تعتمد على تحويل الكـروم إلى مركب يوديد، ثم تفكيكه على سلك مسخن:
تفاعلات الكروم Chemical properties of Chromium
(1) التفاعل مع الهواء
– يعتبر الكـروم من المعادن الخاملة غير الفعالة في الهواء، إذ يشكل طبقة رقيقة من أكسيد الكـروم تحمي المعدن من الأكسدة اللاحقة، وهذه الطبقة هي التي تعطيه اللمعان الجذاب بعد جليها تنعيمها.
وعند رفع درجة الحرارة في جو من الأكسجين فان عملية الأكسدة تتم ببطء ويتشكل أكسيد الكـروم:
(2) التفاعل مع الأحماض
تؤثر الأحماض (H2SO4) و ( (HCl) على الكـروم ببطء إلا إذا كان معدن الكروم على شـكل مسحوق فإنه يتأثر بسرعة.
كما يؤثر فيه حمض النتريك ويشكل عليه طبقة رقيقة من أكسيد الكـروم تقي المعدن من التفاعل اللاحق.
(3) التفاعل مع اللامعادن
يتحد الكروم مع العديد من أشباه المعادن Te ،Se ،B ،Si ،C ،S ،P ،N ويعطي مركبات نصف معدنية.
(4) التفاعل مع الهالوجينات
يتفاعل غاز الفلور مع الكـروم عند درجة الحرارة العادية، أما بقية الهالوجينات تتفاعل مع الكروم بالتسخين:
استخدامات الكروم Uses of Chromium
(1) يستخدم الكـروم في صناعة الفولاذ وسبائك أخرى، كما يستخدم للطلي، وكمادة إضافية للحد من التآكل.
(2) للكروم شهرة في المركبات الملونة، لذا فقد استخدم أيضاً في صناعة الأصبغة والملونات للدهانات، وفي صناعة القرميد في الأفران، ودباغة الجلود وفي حفظ الأخشاب.
(3) يستخدم على نطاق واسع في تلبيس سطوح بعض المعادن السريعة التأكسد بالهواء كالحديد والفولاذ بغية حمايتها من الأكسدة وإعطائها اللمعان والبريق الجميل.
تأثير الكروم على جسم الإنسان
– يمكن للكروم أن يدخل إلى الجسم عن طريق تنفس الهواء وماء الشرب وتناول الطعام.
– عندما يدخل عن طريق التنفس تتجمع جسيمات الكـروم في الرئتين. والجسيمات المتجمعة منها عند أعلى الرئتين غالباً ما تخرج خلال السعال لتنتهي إلى المعدة عن طريق البلع، ويمكن لبعض الجسيمات المتجمعة في عمق الرئتين أن تنحل، الأمر الذي للكروم بالعبور خلال البطانة الرئوية والوصـول إلى مجرى الدم، حيث يدخل في جميع أنحاء الجسم. وهكذا يمر عبر الكليتين ويطرد مع البول خلال عدة أيام.
– يبدي الكـروم الثلاثي سـمية قليلة جداً ولم يعرف له أي سـبب للسرطان.
– في حين يمكن أن يكون الكـروم السداسي ساماً، كما أنه يسبب السرطان إذا أدخل عن طريق التنفس. فعندما يستنشق، يمكن له أن يخرب بطانة الأنف والحنجرة ويثير الرئتين وكذلك القناة المعدية – المعوية. وعند دخوله عن طريق البلع، يمكنه إفساد المعدة وتخريب الكبد والكليتين.
– يعد الكـروم السداسي من المواد التي صنفتها وكالة حماية البيئة كمواد مسرطنة للإنسان، وكذلك بناء على دراسات أجريت على عمال مصـانع معالجة الكروم الذين عانوا من سرطان الرئة بعد تعرض مزمن للاستنشاق.
– رغم ذلك، فان الكـروم السداسي الداخل عن طريق الغذاء لا يسبب السرطان، والسبب في ذلك على الأرجح، أنه يتحول بسرعة إلى كروم ثلاثي بعد دخوله المعدة.
المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- العناصر الانتقالية – كتاب الصف الثالث الثانوى – جمهورية مصر العربية 2021