اليود Iodine – الخواص الفيزيائية والكيميائية لليود
محتويات الموضوع
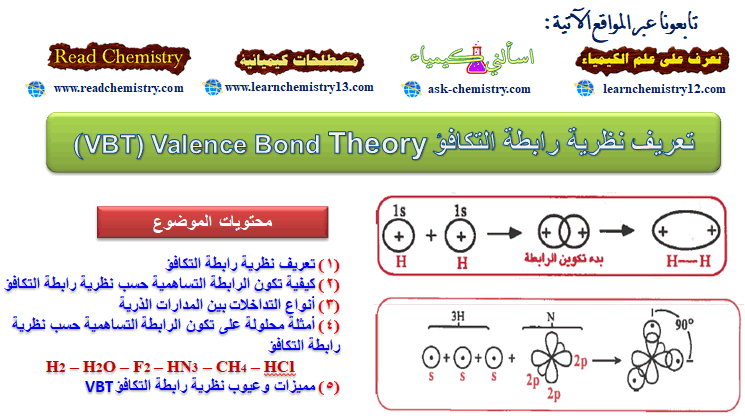
ما هو عنصر اليود Iodine؟
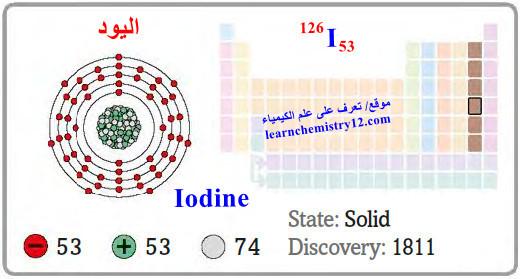
– اليود Iodine هو عنصر من عناصر الجدول الدوري: العدد الذري = 53 ، العدد الكتلي = 126
– الرمز الكيميائي لعنصر التيلوريوم يرمز له بالرمز: 126I53
– التوزيع الإلكتروني له: Kr]36 5s2 4d10 5p5]
– اليود فلز مبلور في درجة الحرارة العادية.
– عنصر سهل التسامي ويعطي عند تساميه غازاً بنفسجياً.
– يذوب اليود في ثاني كبريتيد الكربون، وفي الكلوروفورم مكونا محاليل بنفسجية اللون.
– اليود هو الهالوجين الوحيد الذي يكون صلبًا في درجة حرارة الغرفة.
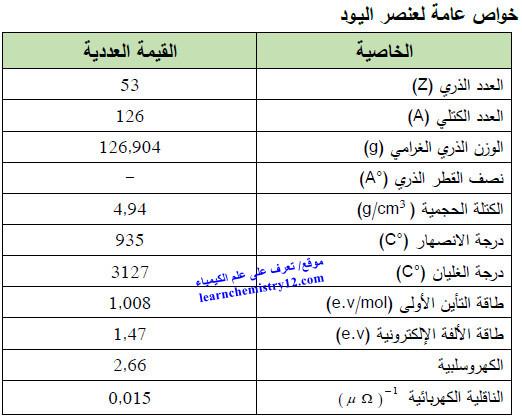
– الجدول التالي يوضح الخواص العامة لعنصر اليود كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Iodine
– اكتشف اليود عام 1811م من قبل العالم (كورتوا) عندما سخن مستخلصات الأعشاب البحرية من حمض الكبريتيك، ولاحظ ظهور أبخرة بنفسجية اللون تحولت عند تبريدها إلى مادة سوداء اللون أطلق عليها اسم اليـود.
– سمي على اسم الكلمة اليونانية iodes أو (يودين)، والتي تعني (اللون البنفسجي).
– يعتبر اليـود من العناصر النادرة في الطبيعة حيث تبلغ نسبته في القشرة الأرضية من 0 ، 3 جرام في الطن.
– يوجد في مياه البحر والطحالب البحرية كما يوجد مختلطاً بالأملاح مثل نترات الصوديوم الطبيعية على شكل يودات أو يوديد تشيلي.
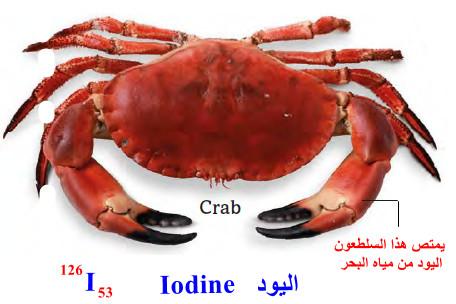
– يوجد اليـود في الأسماك ونذكر منها: سرطان البحر، التونة، الرنجة، السردين، السلمون، بلح البحر، الكركند، الأخطبوط والطحالب بالإضافة إلى الأعشاب البحرية مثل الأعشاب الحمراء.
– كما يوجد في الفواكه مثل الأناناس المشمش، والخضروات مثل الخس، الفاصوليا، اللفت والجرجير.
– يوجد أيضاً في حليب الأم، الجبن، الزبادي والبيض.
– يرجع اللون الأحمر الساطع لهذه الكرز إلى صبغة اليود.
طرق تحضير اليود Preparation of Iodine
(1) من الأعشاب البحرية
– يحتوي الرماد الناتج عن حرق الأعشاب البحرية على نحو 1% تقريباً من اليـود.
– يوضع الرماد في الماء فتنفصل منه بلورات الأملاح مثل كبريتات البوتاسيوم وكلوريد البوتاسيوم.
– يعامل المحلول المركز بعد ذلك بحمض الكبريتيك ويقطر مع ثاني أكسيد المنغنيز وتستقبل أبخرة اليود المتصاعدة في مكثفات.
(2) من نترات الصوديوم (نترات شيلي)
– يوجد في المحاليل المركزة الناتجة من إذابة نترات شيلي (نترات الصوديوم) على هيئة يودات الصوديوم بنسبة تصل لنحو 0% – 3%
– يستخلص اليود عن طريق اختزاله بمركب كبريتيد الصوديوم كما بالتفاعل التالي:
2NaIO3 + 5NaHSO3 → I2 + 2Na2SO4 + 3NaHSO4 + H2O
– ينقى اليـود الناتج من العمليات السابقة بالتسامي مع إضافة قدر صغير جداً من يوديد الصوديوم للتخلص من الهالوجينات الأخرى إن وجدت.
– عادة ما تتسامى مع أبخرة اليود المحضرة من الأعشاب البحرية بلورات لا لون لها من سيانيد اليـود ICN السامة التي تتصاعد قبل أبخرة اليود، ولذلك يجب التخلص منها.
مركبات اليود Iodine Compound
(1) أكاسيد اليود
– يشكل اليـود مع الأكسجين عدة أكاسيد أهمها أكسيد اليـود الخماسي I2O5 الذي يحضر بإزالة الماء من حمض اليود ذي درجة أكسدة (+5) بالتسخين في الدرجة 200 مo كما بالتفاعل التالي:
2HIO3 → I2O5 + H2O
– I2O5 مادة صلبة بيضاء اللون وتتفكك إلى عناصرها ابتداء من درجة الحرارة 300مo
– ويتفاعل مع الماء مشكلاً حمض اليود، ولذا يعتبر مؤكسداً قوياً يتفاعل مع أكسيد الكربون كما بالتفاعل التالي:
I2O5 + 5CO → 5CO2 + I2
(2) أحماضه الأكسجينية وأملاحه
(أ) حمض اليود ذو درجة أكسدة (+1) HIO
– لا يعرف لهذا الحمض إلا في محاليله وهو حمض ضعيف (K = 10-14) إلا أن له خواص مؤكسدة قوية.
– ويحضر بتفاعل اليـود مع الماء كما بالتفاعل التالي:
I2 + H2O → HI + HIO
– يمكن ترسيب الأيون –I بترسيب أيون الزئبق كما بالتفاعل التالي:
HgO + 2I2 + H2O → HgI2 + 2HIO
(ب) حمض اليود ذو درجة أكسدة (+5) HIO3
– هذا الحمض جسم صلب بلوري أبيض اللون.
– سهل الانحلال في الماء (30 جرام في 100 جرام من الماء بالدرجة 16مo).
– يتحول حمض اليـود إلى الأكسيد I2O5 بالدرجة 230 مo ولهذا يعتبر هذا الأكسيد بلا ماء الحمض HIO3
– يتفكك بدرجة حرارة 275 مo كما بالتفاعل التالي:
2HIO3 → I2O5 + H2O
– أن حمض اليـود (+5) حمض قوي له خواص مؤكسدة.
– يحضر بأكسدة اليـود بحمض النتروجين (+5) المركز والساخن أو بعامل مؤكسد قوي آخر كالأوزون أو الماء الأكسجيني.
2I2 + 10HNO3 → 6HI3 + 10NO +2H2O
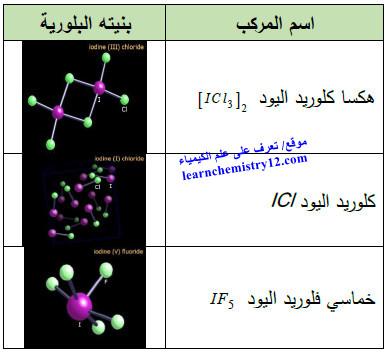
(3) مركبات أخرى
الجدول التالي يوضح أسماء مركبات اليـود الأخرى المشهورة كما يلي:
الخواص الكيميائية لعنصر اليود Chemical properties of Iodine
(1) التفاعل مع الهواء
– لا يتفاعل اليود لا مع الأكسجين ولا مع النيتروجين ولكنه يتفاعل مع الأوزون لتشكيل مركب غير مستقر من I4O9 والذي يكون بالشكل I(IO3)3
(2) التفاعل مع الماء
– يتفاعل اليود مع الماء لتكوين محاليل بها شوارد –IO كما بالتفاعل التالي:
I2(1) + H2O (1) → OI– (aq) + 2H+(aq) + I–(aq)
(3) التفاعل مع الهالوجينات
– يتفاعل اليود مع الفلور F2 في درجة حرارة الغرفة لتشكيل بنتافلوريد اليـود، وفي درجة الحرارة 250مo يتفاعل معه لتشكيل هبتا فلوريد اليـود، وفي درجة حرارة -45 مo يتفاعل معه كذلك لتكوين ثلاثي فلوريد اليـود، كما بالتفاعلات التالية:
عديم اللون (l)I2(s) + 5F2(g) → 3IF5
عديم اللون (g)I2(g) + 7F2(g) → 2IF7
أصفر (s)I2(s) + 3F2(g) → 2IF3
– كما يمكن لليود أن يتفاعل مع البورم لتكوين مركب صلب غير مستقر (انتر هالوجين) كما بالتفاعل التالي:
(s)I2(s) + Br2(l) → 2IBr
– كما يتفاعل اليود مع الكلور في درجة الحرارة -80 مo لتكوين I2Cl6 ، ويتفاعل معه أيضاَ في وجود الماء لتكوين حمض اليود، كما بالتفاعلات التالية:
أصفر (s)I2(s) + 3Cl2(g) → I2Cl6
I2(s) + 6H2O(1) + 5C12(g) → 2HIO3(s) + 10HCl(g)
(4) التفاعل مع الأحماض
– يتفاعل اليود مع الأحماض لتكوين حمض اليود الذي يتبلور بالتبريد، كما بالتفاعل التالي:
3I2(s) + 10HNO3(aq) → 6HIO3(s) + 10NO(g) +2H2O(1)
(5) التفاعل مع القواعد
– يتفاعل اليود مع القواعد الساخنة كما بالتفاعل التالي:
3I2(g) + 6OH–(aq) → IO3–(aq) + 5I–(aq) + 3H2O
(6) التفاعل مع الهيدروجين
– يتحد اليود مباشرة مع الهيدروجين، وذلك بخلط أبخرته مع غاز الهيدروجين وتمرير الخليط في أنبوبة ساخنة.
– لا يسرى هذا التفاعل إلى نهايته، لكنه يصل إلى حالة اتزان تختلف باختلاف درجات الحرارة التي يجري عندها التفاعل.
H2 + I2 → 2HI + 2.6400 Calories
– كما يحضر يوديد الهيدروجين باختزال اليود بكبريتيد الهيدروجين.
10I2 + H2S → 2HI + S
– أو باختزال اليود بواسطة الفوسفور الأحمر بوجود الماء مع التسخين كما بالتفاعل الآتي:
10I2 + P4 + 10H2O → 20HI + 4H3PO4
– كما إن يوديد الهيدروجين لا لون له، يتحول إلى سائل كثيف تصل إلى 2.2 غ /سم3
– وعند تبريده إلى -36مo يتحول إلى مادة صلبة، يذوب في الماء مكوناً حمض الهيدروكلوريك.
(7) التفاعل مع الفلزات
– يتحد اليود مع الفلزات مباشرة نذكر منها الزئبق ليكون يود الزئبق Hg2I2 على هيئة قشور خضراء على سطح الزئبق وفق التفاعل التالي:
2Hg + I2 → Hg2I2
– وفي وجود زيادة من اليود يتكون يود الزئبق ذو درجة أكسدة (+2) وهو أحمر اللون.
(8) التفاعل مع اللافلزات
– يمكن لليود أن يعطي مركبات أحادية التكافؤ باتحاده مباشرة مع كل من الكلور، البروم، الفلور والفوسفات.
استخدامات اليود Uses of Iodine
(1) يلعب اليود دوراً أساسياً في جسم الإنسان فهو يسهم في آلية أكسدة الخلايا على مستوى الكبد في إنتاج الكريات الحمراء.
(2) ينظم عملية النمو ووظيفة الأعصاب والعضلات وعملية تحويل الطاقة وتسريع عملية الاستقلاب.
(3) كما يساعد على حرق الدهون الزائدة.
(4) اليـود عنصر بيولوجي فهو ضروري للغدة الدرقية التي بها نمو الإنسان.
(5) يعتبر اليـود معقمًا قويًا، وهذا ما يفسر استعماله طبياً بدرجة أساسية مثل صبغة اليود المشهورة التي تعقم الجروح.
(6) قد أشير قديماً إلى استخدام اليـود في مداواة السل.
(7) كما أن يود الرصاص مقاوم للأورام بالإضافة إلى هذا فقد أصبح لليود تطبيقات جديدة فالسيارات تجهز بمصابيح ذات بخار اليود، والتي تعطي نوراً ساطعاً يمكن من تمييز الحواجز تمييزاً جيداً.
(8) يستعمل يود الفضة منذ زمن طويل في التصوير.
(9) يستخدم اليـود أيضًا في صناعة حبر الطباعة وصبغات الطعام الحمراء والبنية والمطهرات.
(10) يستخدم اليـود أيضًا في صناعة حبر الطباعة وصبغات الطعام الحمراء والبنية والمطهرات.
تأثير اليود على صحة الإنسان
(1) نقص اليود في جسم الإنسان
إن نقص اليود في جسم الإنسان يؤدي إلى الأمراض الآتية كما يلي:
– تضخم الغدة الدرقية ومن أعراضها: التعب، الإحباط، فقدان الذاكرة، الضعف، زيادة الوزن الإمساك، العصبية، وسقوط الشعر وجفاف الجلد.
– التخلف العقلي نتيجة النمو العصبي غير الكاف (عند الأطفال).
– موت الجنين أو تشوهات خلقية فيه عند الولادة.
– كما أن هناك ارتباط وثيق بين نقص اليـود وسرطان الثدي.
(2) زيادة اليود في جسم الإنسان
إفراط في تناول اليود يؤدي إلى الأمراض الآتية كما يلي:
- إرهاق الغدة الدرقية
- طفح جلدي
- تقرحات بالفم
- تورم الغدة اللعابية
- الإسهال والقيء
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.







موضوع رائع جداً عن اليود … شكراً جزيلاً