الهولميوم Holmium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الهولميوم Holmium؟
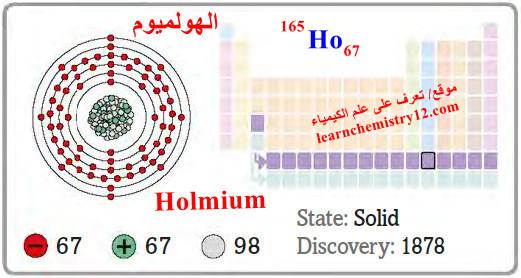
– الهولميوم Holmium هو عنصر من عناصر الجدول الدوري: العدد الذري = 67 ، العدد الكتلي = 164
– الرمز الكيميائي لعنصر الهولميوم يرمز له بالرمز: 164Ho67
– التوزيع الإلكتروني له: Xe]54 6s2 4f11]
– الهولميوم عنصر فلزي أبيض طري لامع فضي.
– وهو ثابت في الهواء الجاف وتحت درجة حرارة الغرفة ولكنه يتأكسد بسرعة في الهواء الرطب.
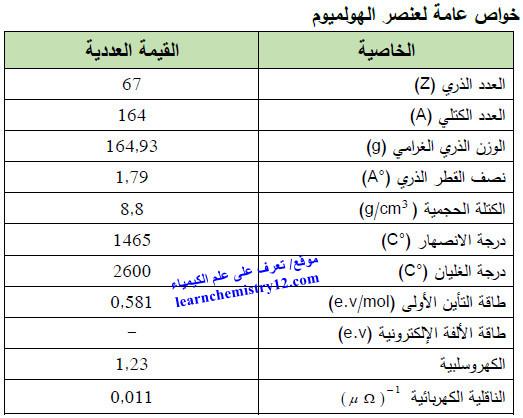
– الجدول التالي يوضح الخواص العامة لعنصر الهولميوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Holmium
– أكتشف على يد الكيميائي السويدي بير تيودور كليف Per Teodor Cleve عام 1878م..
– يسمى الهولميوم بهذا الأسم نسبة للكلمة اللاتينية (holmia) وتعني ستوكهولم وهى مدينة سويدية.
– يمكن للهولميـوم النقي أن ينتج مجالًا مغناطيسيًا قويًا، ولذلك يستخدم في المغناطيسات.
– مثل كل اللانثانيدات، فإن الهولميـوم لا يوجد منفرداً في الطبيعة ويوجد متحداً مع المعادن الأخرى مثل: الجادولينايت والمونازيت وعناصر أخرى من مجموعة الأتربة النادرة.
تحضير الهولميوم Preparation of Holmium
– يتم استخراج الهولميوم تجارياً عن طريق التبادل الأيوني لأتربة المونازيت التي تحتوي على نسبة %0,05 من معدن الهولميوم.
– ولكن لازال من الصعوبة عزل الهولميوم عن معادن الأتربة النادرة الأخرى.
مركبات الهولميوم Holmium Compound
(1) ثلاثي كلوريد الهولميوم HoCl3
– هو مركب كيميائي غير عضوي يستخدم بشكل رئيسي في مجال البحوث وذلك لكونه يأخذ اللون الأصفر في الإضاءة الطبيعية ويتغير لونه إلى الوردي المشرق في إضاءة الفلورسنت. (Fluorescent)
– يمكن تحضيره عن طريق مزج خليط من ثلاثي أكسيد الهولميـوم وكلوريد الأمونيوم عند درجة الحرارة 200Co – 250°C كما بالتفاعل التالي:
Ho2O3 + 6NH4Cl → 2HoCl3 + 6NH3 + 2H2O
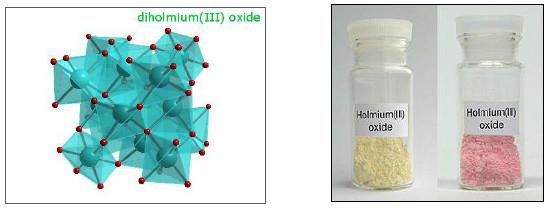
(2) ثلاثي أكسيد الهولميوم Ho2O3
– يتميز بلونه الأصفر في وضح النهار أي تحت ظروف الإضاءة العادية وباللون الناري (البرتقالي الأحمر) تحت الإضاءة ثلاثية الألوان.
– علاوة على ذلك يستخدم في صنع النظارات الملونة.
– كما يستخدم في صناعة الزجاج خاصة تلوينها بالأصفر والأحمر.
– ثلاثي أكسيد الهولميـوم مقارنة مع مركبات أخرى كثيرة ليس خطيرًا للغاية على الرغم من أن التعرض المفرط له يمكن أن يسبب الورم الجيبي ونقص الهيموغلوبين الحر في الدم، وجرعته غير مميزة إلا إذا تعدت 1 جرام لكل كيلو جرام من وزن جسم الإنسان.
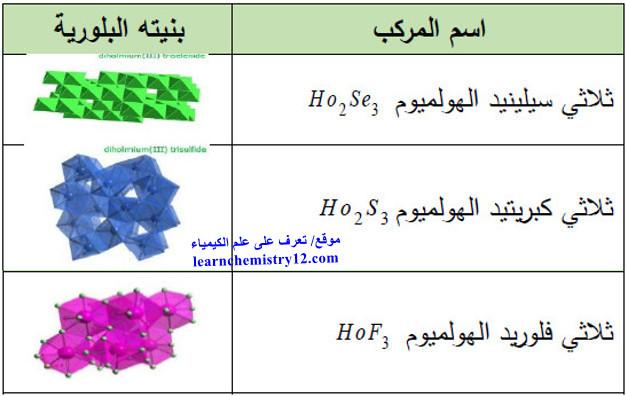
(3) مركبات أخرى
الجدول التالي يوضح المركبات الأخرى المشهورة لهذا العنصر Ho كما يلي:
الخواص الكيميائية لعنصر الهولميوم Chemical properties of Holmium
(1) التفاعل مع الهواء
– الهولميوم يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثلاثي أكسيد الهولميـوم ذو الصيغة Ho2O3 كما بالتفاعل التالي:
4Ho + 3O2 → 2Ho2O3
(2) التفاعل مع الماء
– يتميز الهولميوم بالكهروإيجابية العالية فيتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد الهولميـوم Ho(OH)3 وغاز الهيدروجين H2 كما بالتفاعل التالي:
2Ho (s) + 6H2O(g) → 2Ho(OH)3(aq) + 3H2(g)
(3) التفاعل مع الهالوجينات
– الهولميـوم المعدني يتفاعل مع كل الهالوجينات لتشكيل هاليدات الهولميـوم الثلاثية فيتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي: ثلاثي فلوريد الهولميـوم، ثلاثي كلوريد الهولميـوم، ثلاثي بروميد الهولميـوم، ثلاثي يوديد الهولميـوم، كما بالتفاعلات التالية:
(وردي) 2Ho (s) + 3F2(g) → 2 HoF3 (s)
(أصفر) 2Ho (s) + 3Cl2(g) → 2 HoCl3 (s)
– وأيضاً يتفاعل بنفس الطريقة مع البروم واليود كما يلي:
(أصفر) 2Ho (s) + 3Br2(g) → 2 HoBr3 (s)
(أصفر) 2Ho (s) + 3I2(g) → 2 HoI3 (s)
(4) التفاعل مع الأحماض
– معدن الهولميوم يذوب بسهولة في حمض الكبريتيك المخفف لتشكيل محاليل تحتوي على أيونه الثلاثي وفق التفاعل التالي:
2Ho(s) + 3H2SO4(aq) → 2Ho3+(aq) + 3So42- (aq) + 3H2 (g)
استخدامات الهولميوم Uses of Holmium
(1) تستخدم مركباته في صنع أشعة الليزر ومن أهم استخداماتها تكسير حصى الكلية بالليزر.
(2) كما يستخدم لصناعة الأدوات الإلكترونية.
(3) علاوة على ذلك يستخدم لطلاء الزجاج لعكس الأشعة الفوق بنفسجية.
(4) هو أحد الملونات المستخدمة في المجوهرات وذلك لتوفير لون مزدوج بين الأصفر والخوخي وكذلك اللون الأحمر مثل مكعب الزركونيا Cubic Zirconia
(5) يمكن استخدامه على هيئة أيون نشط في بعض أجهزة الليزر في الحالة الصلبة.
(6) للهولميـوم دوراً فعالاً في عملية الأيض.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017