الرينيوم Rhenium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الرينيوم Rhenium؟
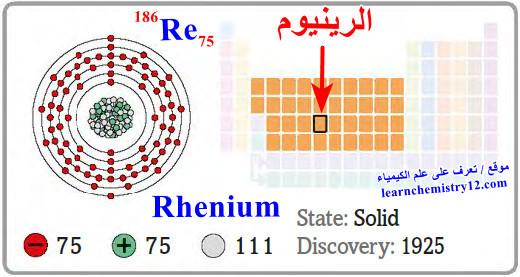
– الرينيوم Rhenium هو عنصر من عناصر الجدول الدوري: العدد الذري = 75، العدد الكتلي = 186
– الرمز الكيميائي لعنصر الرينيوم يرمز له بالرمز: 186Re75
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d5]
– الرينيوم فلز فضي اللون، ثقيل وصعب الانصهار.
– كما يمتاز بمقاومته العالية للكهرباء.
– إن الرينيوم النقي قابل للسحب والطرق.
– يوصف من الفلزات المقاومة للتأكل لكنه يتأكسد ببطء بالحرارة إذا كان في جو من الأكسجين.
– لا يتأثر فلز الرينيوم بحمض HCl أو HF لكنه يتأثر ببطء بحمض الكبريتيك، ويهاجمه حمض النيتريك HNO3 بعنف مشكلاً حمض فوق الرينيـوم HReO4
– يصبح فلز الرينيـوم قاسياً جداً عندما يتغلغل الهيدروجين في شبكته البلورية كما يصبح قليل التوصيل للكهرباء.
– الرينيوم النقي أكثر كثافة من الذهب.
– الرينيوم لديه أعلى نقطة غليان من أي عنصر.
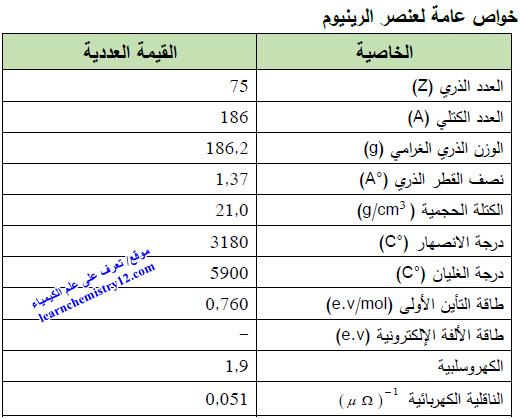
– الجدول التالي يوضح الخواص العامة لعنصر الرينيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Rhenium
– اكتشف من قبل العالمين (الترنوداك) و (ايراتايك) سنة 1925م.
– اشتق اسمه من الكلمة الألمانية (Rhien) والتي تعني نهر الراين، وكان آخر عنصر مستقر وغير مشع يتم العثور عليه.
– يوجد ممتزجاً بخامات المولبيدن وخاصة خام المولبيدنيت Molybdenite بنسبة لا بأس بها كما أن بعض الفلزات المعدنية في النرويج تحتوي 20 جزءًا بالمليون من معدن الرينيوم.
– الرينيوم نادر جدًا في الطبيعة: ذرة واحدة فقط من كل مليار في قشرة الأرض هي ذرة رينيوم.
تحضير الرينيوم Preparation of Rhenium
– يمكن الحصول على فلز الرينيوم من اختزال رينات الأمونيوم NH4ReO4 بالهيدروجين بدرجة حرارة 400 مo.
– كما يستخلص أيضاً بالأكسدة القوية لمركبات الرينيوم فنحصل على أيونات فوق الرينات –[ReO4]
– وبإضافة محلول KCl يرسب ملح فوق رينات البوتاسيوم KReO4 قليل الذوبان، وينقى هذا الملح بالبلورة المتتابعة.
2KOH + 2Re + 6H2O → 2KReO4 + 7H2
– يغسل مسحوق الرينيوم بالماء للتخلص من هيدروكسيد البوتاسيوم، ويفضل اختزال فوق رينات الأمونيوم NH4ReO4 عوضاً عن فوق رينات البوتاسيوم KReO4 لأن مسحوق الرينيـوم الناتج عن فوق رينات الأمونيوم لا يحتاج لعملية الغسل.
مركبات الرينيوم Rhenium Compounds
(1) أكاسيد الرينيـوم Oxides Rhenium
(أ) ثالث أكسيد الرينيوم ReO3
– في هذه المركب تكون درجة أكسدة الرينيوم (6+)
– نحصل على هذا الأكسيد من التفكك الحراري لمركبات الإضافة ReO7[C4H8O2] للأكسيد ReO7 ، وثنائي أوكسان C4H8O2، بتسخين أكسيد الرينيوم ReO3 نحصل على أكسيدين للرينيـوم ذوي درجات أكسدة مختلفة، وذلك على النحو التالي:
3Re2O7 + ReO2 → ReO3
– لأكسيد الرينيوم ReO3 بنية مكعبة، وبتفاعله مع الأسس القلوية تتشكل أملاح الرينات M2ReO4
(ب) أكسيد الرينيوم السباعي Re2O7
– نحصل عليه من تسخين الرينيوم بالهواء أو في جو من الأكسجين أو بتسخين أكاسيد الرينيوم الأخرى بدرجة 200 مo
– يتميز هذا الأكسيد بجسم صلب أصفر يختزل تحت درجة 300 مo أو بالهيدروجين إلى ثاني أكسيد الرينيـوم ReO2.
(2) هاليدات الرينيـوم Halides Rhenium
(أ) كلوريد الرينيـوم الثلاثي ReCl3
– نحصل عليه من التفكك الحراري لكلوريد الرينيـوم الخماسي ReCl5 كما بالمعادلة:
ReCl5 → ReCl3 + Cl2
(ب) بروميد الرينيـوم الثلاثي ReBr3
– نحصل عليه من تأثير البروم في معدن الرينيـوم في درجة حرارة 300 مo كما بالمعادلة الآتية:
2Re + 3Br2 → 2ReBr3
(جـ) فلوريد الرينيـوم السداسي ReF6
– الذي نحصل عليه من تأثير غاز الفلور على الرينيـوم 120 مo بدرجة ويتميه كما يلي:
3ReF6 + 10H2O → ReO2 + 2HReO4 + 18HF
– يؤثر فلوريد الرينيـوم السداسي في السليكا كما بالمعادلة:
2ReF6 + SiO2 → SiF4 + 2ReOF4
(د) فلوريد الرينيـوم الرباعي ReF4
– الذي نحصل عليه من اختزال فلوريد الرينيـوم السداسي ReF6
(هـ) كلوريد الرينيـوم الخماسي ReCl5
– نحصل عليه من تأثير غاز الكلور بالحرارة على الرينيوم.
(3) أحماض الرينيـوم Acids Rhenium
– يعتبر الحمض HReO4 وأملاحه من المركبات المهمة، ونحصل عليه من الأكسدة المباشرة لأكسيد الرينيوم الرباعي ReO2 بغاز الكلور، فنحصل على معلق الحمض في السائل.
2ReO2 + 3Cl2 + 4 H2O → 3HReO4 + 6HCl
– يمتاز الحمض HReO4 بقوته إذ يؤثر في معدن الزنك والحديد والماغنسيوم ويطلق الهيدروجين لكن هذا الحمض من المؤكسدات الضعيفة والمختزلات القوية.
(4) كبريتيد الرينيـوم Re2S7
– لا يعتبر كبريتيد الرينيوم من المركبات نصف المعدنية، وهو ذو رابطة تساهمية.
– يتشكل عند غليان فوق رينات البوتاسيوم KReO4 مع كبريتات الصوديوم Na2S2O7 أو من تأثير غاز H2S في محلول حمضي قوي لفوق الرينات وبعد التسخين في جو من النتروجين يعطي ReS2 , Re2O7
استخدامات الرينيوم Uses of Rhenium
(1) إن أهم وأحدث مجال لاستعمال الرينيوم هو الوساطة (التحفيز) فقد تبين أن الرينيـوم والعديد من سبائكه ومركباته وسائط ممتازة في عمليات مختلفة مثل: أكسدة النشادر وتحول الإثلين إلى إيثان والحصول على الألدهيدات والكيتونات من الكحولات وعملية تكسير البترول.
(2) يستعمل الرينيوم في صناعة مختلفة لا تتأثر بدرجة الحرارة والأحماض لذلك يستخدم طلاء أسلاك التنجستن التي تستعمل في المصابيح الكهربائية، الأنابيب الإلكترونية وأجهزة التفريغ الكهربائية، ولن يحتاج إلى كمية كبيرة من الرينيـوم، إذ يكفي جرام واحد منه لتغطية مئات الأمتار من أسلاك التنجستن.
(3) يتمتع الرينيوم بنقطة انصهار عالية جدًا، ويمكن أن يظل صلبًا عند درجات الحرارة القصوى. وهذا يسمح باستخدام السبائك المصنوعة من هذا العنصر في الظروف شديدة الحرارة، مثل تلك الموجودة داخل أنابيب أجهزة الأشعة السينية، وكذلك تلك الموجودة في فوهات عادم الصواريخ والمحركات النفاثة للطائرات المقاتلة.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017