الكيمياء العامة
الكيمياء العامة تُعد أساس فروع الكيمياء، تدرس المادة وخواصها وتغيراتها. تشمل الذرات، الجزيئات، التفاعلات، والمعادلات. تساعد في فهم الظواهر الطبيعية وتطبيقات العلوم في الحياة اليومية.
-
تحميل كتاب الكيمياء العامة عملي
استكمالاً لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع مذكرة غاية فى الروعة…
أكمل القراءة » -
الكتاب الشامل بالألوان فى الكيمياء الغير عضوية ” Inorganic Chemistry – Fifth Edition ” للمؤلفين الستة
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب غاية فى الروعة…
أكمل القراءة » -
حساب الرقم الهيدروجيني pH للمحاليل المنظمة
في هذا الموضوع سيتم مناقشة وحساب الرقم الهيدروجيني pH للمحاليل المنظمة pH laws for buffer solution بالتفصيل. تعريف المحاليل المنظمة…
أكمل القراءة » -
تأين الأملاح Disassociation of salts واشتقاق قوانين pH
– وفي هذا الموضوع سيتم مناقشة عن الاتزان في الأملاح (تأين الأملاح) وكيفية اشتقاق قوانين pH للأملاح الناتجة من حمض…
أكمل القراءة » -
تأين الأحماض والقواعد واشتقاق قوانين pH
– في هذا الموضوع سيتم مناقشة الأتزان في الأحماض والقواعد وتأين الأحماض والقواعد Acid – base equilibrium وكيفية اشتقاق قوانين…
أكمل القراءة » -
تفكك الماء – اشتقاق القانون pH + pOH =14
– في هذا الموضوع سيتم مناقشة تفكك الماء Dissociation of water – اشتقاق القانون pH + pOH =14 وكذلك أهم…
أكمل القراءة » -
كتاب أسس الكيمياء غير العضوية تأليف د/ محمد مجدي واصل
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب رائع جداً…
أكمل القراءة » -
كتاب مبادئ الكيمياء العامة (نظري + مسائل محلولة)
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب ” مبادئ الكيمياء…
أكمل القراءة » -
وزن معادلات الأكسدة والاختزال Redox equations
وزن معادلات الأكسدة والاختزال تتم عملية وزن معادلات الأكسدة والاختزال بطريقتين كما يلي: (1) طريقة الأيون – إلكترون (طريقة نصف…
أكمل القراءة » -
كيفية تمييز تفاعلات الأكسدة والاختزال عن غيرها من التفاعلات
– في هذا الموضوع سيتم مناقشة كيفية تمييز تفاعلات الأكسدة والاختزال Redox reactions عن غيرها من التفاعلات مع ذكر الأمثلة…
أكمل القراءة » -
عدد التأكسد – أعداد الأكسدة Oxidation Number
تعريف عدد التأكسد – عدد التأكسد (عدد الأكسدة) Oxidation Number هو عدد الإلكترونات التى يمكن أن يفقدها أو تكتسبها أو…
أكمل القراءة » -
كتاب الكيمياء اللاعضوية باللغة العربية تأليف د/ عصام جرجس
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب “الكيمياء اللاعضوية”…
أكمل القراءة » -
كتاب 3000 مسألة محلولة في الكيمياء pdf – سلسلة المسائل المحلولة شوم
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب رائع…
أكمل القراءة » -
الروابط الهيدروجينية Hydrogen Bonds
– هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في…
أكمل القراءة » -
قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole Attractive Forces
أنواع قوى التجاذب بين الجزيئات Types of Intermolecular Attractive Forces – في هذا الموضوع سيتم مناقشة قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole…
أكمل القراءة » -
قوى التجاذب بين أيون وجزيء ثنائي القطب
– هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في…
أكمل القراءة » -
كتاب الكيمياء غير العضوية – جاري ميسلر مترجم
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذى يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم اليوم كتاب رائع جداً…
أكمل القراءة » -
الأحماض والقواعد ( نظرية أرهينيوس – نظرية برونستند – نظرية لويس )
في هذا الموضوع سنناقش النظريات الثلاثة التى قامت بتعريف الأحماض والقواعد. (1) نظرية أرهينيوس Arrhenius theory للأحماض والقواعد استنتج…
أكمل القراءة » -
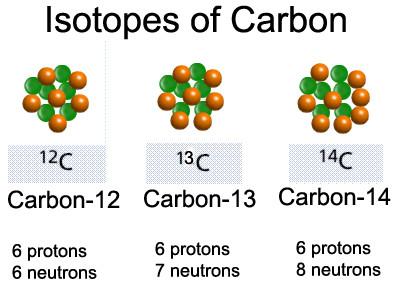
النظائر المشعة والعناصر المشعة
– قبل أن نتكلم فى موضوع الدرس سوف نستطرق بإختصار إلي النشاط الإشعاعي والعناصر المشعة والنظائر المشعة. ما هي النظائر…
أكمل القراءة » -
الترابط الجزيئي Molecular bonding
تعريف الترابط الجزيئي Molecular bonding – الترابط الجزيئي Molecular bonding هو القوي التي تربط بين الجزيئات والتي تحدد كثير من…
أكمل القراءة »