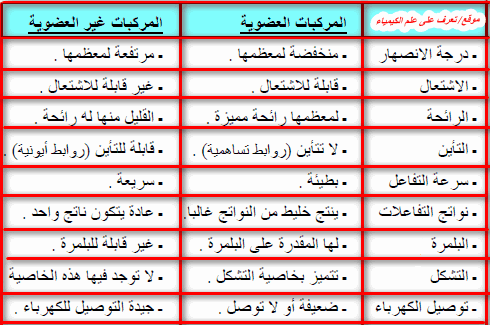
الكيمياءالكيمياء العضوية
الطرق الفيزيائية لتعيين الوزن الجزيئي لمركب كيميائي

الطرق الفيزيائية لتعيين الوزن الجزيئي لمركب كيميائي
Physical Methods for Determination of Molecular Formula
يتم تحديد الوزن الجزيئي لأى مركب عضوي (الصيغة الجزيئية) من خلال الطرق الفيزيائية التالية:
أولاً: قياس الانخفاض في درجة الانصهار
(1) طريقة بيكمان Beckmann Methods
– عند إذابة أى مركب عضوي في مذيب ويعرض المحلول للتبريد والانجماد فإن الانخفاض في درجة
الانجماد تتناسب طردياً مع تركيز المذاب، ويعتمد هذا الانخفاض بالتأكيد وبشكل رئيسي على عدد الجزيئات المذابة.
الانجماد تتناسب طردياً مع تركيز المذاب، ويعتمد هذا الانخفاض بالتأكيد وبشكل رئيسي على عدد الجزيئات المذابة.
– إن ذلك يعنى إذا كان لدينا مركبين مختلفين وبكميات تتناسب مع أوزانها الجزيئية وتم إذابتها في 1000 جم من مذيب فإن لها نفس درجة الانجماد لأن عدد الجزيئات المذابة تكون متساوية في الحالتين.
– وهذا ما يتطابق مع قانون راولت Raoult’s law والذي ينص على (السوائل الحاوية على جزيئات متساوية من مركبات مختلفة في ذات المذيب تعطي او لها درجة إنصهار واحدة).
– لذا فإن الانخفاض المولاري لدرجة الانجماد (E) الناتجة عن إذابة 1 جم/ مول من أي مادة في 1000 جم من مذيب معين يكون ثابتاً لذلك المذيب ويكون 1.86 مo لحمض الخليك ، 5.07مo للبنزين.
– ويمكن استخراج الوزن الجزيئي لأى مركب عضوي مجهول من هذه الثوابت فإذا أخذنا (a) جم من مركب مجهول وأذيبت في (b) جم من المذيب وكان درجة الانخفاض المولاري (E) معروفاً والانخفاض في درجة الانجماد مقاساً بواسطة طريقة بيكمان (Δt) فإن الوزن الجزيئي للمركب المجهول (M) يمكن حسابه من تطبيق المعادلة:
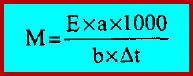
(2) طريقة راست Rast’s Method
– طريقة راست وهي طريق بسيطة تعتمد كذلك على انخفاض درجة الانجماد (الانصهار) والمدى الواسع التى تجرى فيه لكونها تستخدم أنابيب كبيرة مع مقياس حرارة اعتيادي.
– يستخدم مركب الكامفور (الكافور) كميب لأن له ثابت انخفاض مولاري لدرجة الانجماد E = 40o .
– أن درجة الانصهار للكافور النقي هو 177مo . وعند إذابة (1 مول) من المركب المراد معرفة وزنه الجزيئي في 1000 جم من الكافور بالتسخين فإن درجة انصهار المزيج سوف يكون بحدود 137 مo . وعملياً فإن (α) جم حين تذاب (تصهر) في (b) جم من الكافور النقي.
** عند تطبيق المعادلة التالية سوف نتمكن من معرفة الوزن الجزيئي للمركب المجهول (M):
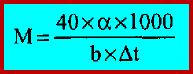
– وهذه الطريقة تستخدم فقط مع المركبات التي تذوب في الكافور ولا تتفاعل معه كما أنها لا تتفكك بالحرارة.
ثانياً/ قياس الارتفاع في درجة الغليان
– استناداً إلى قانون راولت فإن الأوزان الجزيئية المتساوية في نفس المذيب تعطى ليس نفس درجات الانصهار وحسب بل تعطي نفس درجات الغليان. وعلى هذا الأساس يمكن حساب الأوزان الجزيئية وبنفس الطريقة الارتفاع في درجة الغليان. والذي يتناسب طردياً مع الانخفاض في الضغط البخاري.
– عن الارتفاع المولاري في درجة الغليان E᷆ ( 1مول من المادة مذاب في 1000جم من المذيب) يكون عادة غير واضح كما في حالة الانخفاض المولاري لدرجة الانصهار E ، قيمته 0.51o للماء ، 2.53o لحمض الأستيك الثلجي ، 2.66o للبنزين ، 3.59o للكلورفورم.
– إذا أذيب (α) جم من المادة معرفة وزنها الجزيئي في (b) جم من المذيب الذي له درجة الارتفاع المولاري E᷆
وكان الارتفاع في درجة الغليان (Δt) فإن الوزن الجزيئي M يمكن حسابه وفق المعادلة التالية:
وكان الارتفاع في درجة الغليان (Δt) فإن الوزن الجزيئي M يمكن حسابه وفق المعادلة التالية:
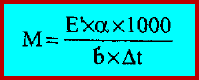
ثالثاً: ملاحظات هامة
(1) بالرغم من حسابات الوزن الجزيئي هذه تكون أحياناً غير دقيقة النتائج وهذا غير مهم في استخراج الصيغة
الجزيئية لأن ذلك يساعدنا في التوصل إلى ابسط صيغة وضعية أو مضاعفاتها ومن ثم التوصل إلى الوزن الجزيئي الذي يتطابق مع القيم العملية.
الجزيئية لأن ذلك يساعدنا في التوصل إلى ابسط صيغة وضعية أو مضاعفاتها ومن ثم التوصل إلى الوزن الجزيئي الذي يتطابق مع القيم العملية.
(2) لا تصلح الطرق المذكورة سابقاً في استخراج الأوزان الجزيئية للمركبات الكبيرة والعملاقة. والتي عادة ما تكون بوليمرات ذات أوزان جزيئية بقياس الضغط الأسموزي لمحاليها أو تطبيق طرق أخرى مثل قياسات معدلات الانتشار أو معدلات ترسبها في أجهزة الطرد المركزي الفائقة أو درجة اللزوجة أو التشتت الضوئي لمحاليلها (طريقة تيندال Tyndall Methods(
(3) كل هذه الطرق تعطي فقط معدل الوزن الجزيئي (التقريبي) بسبب أن جزيئات البوليمر الكبير المصنع يختلف في الحجم. ولأن عدداً من البوليمرات الطبيعية هي مركبات متجمعة تعتمد على درجة الحموضة PH. والنتيجة أن الوزن الجزيئي الحقيقي للعديد من النواتج الطبيعية مثل السكريات المتعددة والبروتينات تكون معروفة تقريباً.
(4) ولما كان شكل الجزيئية يمكن ان يؤثر على قيمة الوزن الجزيئي فان الأخير يهيئ أحياناً بعض الدلائل على المؤثرات الفراغية للجزئية.
(5) البوليمرات ذات الأوزان الجزيئية التي تتراوح بين 1000– 10000 والتي تسمى شبة الغرويات. Hemicolloids فأن هنالك بعض الطرق المطورة التي تعتمد لمعرفة الأوزان الجزيئية لها.
المراجع : الكيمياء العضوية الإليفاتية/ عادل شاكر الطائي – دايخ عيد الحسناوي /الطبعة الأولي 2009/عمان – الأردن