الراديوم Radium – الخواص الفيزيائية والكيميائية للراديوم
محتويات الموضوع
ما هو عنصر الراديوم Radium؟
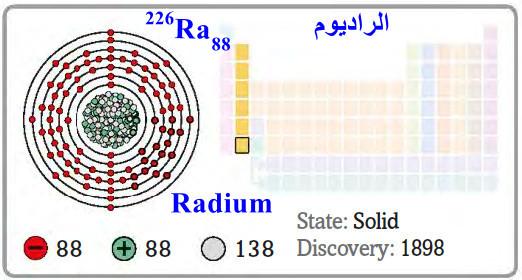
– الراديوم Radium هو عنصر من عناصر الجدول الدوري: العدد الذري = 88 ، العدد الكتلي = 266
– الرمز الكيميائي لعنصر الراديوم يرمز له بالرمز: 226Ra88
– التوزيع الإلكتروني له: Rn]86 7s2]
– (Ra) عنصر كيميائي مشع ذو لون أبيض نقي تقريباُ
– وهو من المعادن القلوية الترابية، ولكنه يتأكسد بسهولة عند تعرضه للهواء، فيصبح أسود اللون.
– ينتج عن اضمحلاله الإشعاعي غاز الرادون.
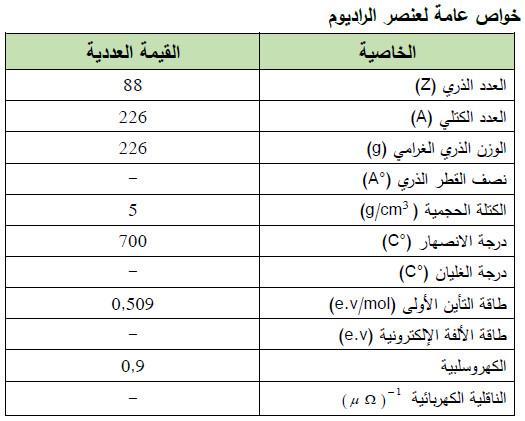
– الجدول التالي يوضح الخواص العامة لعنصر الراديوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Radium
– اكتشفه الزوجان بيير وماري كوري في عام 1898م، حيث قامت حيث وجدوا أن خامات اليورانيوم تنتج نشاطًا إشعاعيًا أكثر مما كان متوقعًا من عينات اليورانيوم. لقد أدركوا وجود معدن آخر مشع وأطلقوا عليه اسم الراديوم (Ra)
– قام ماري كوري وأندريه لويس دوبييرن بفصل (Ra) من خلال التحليل الكهربائي لكلوريد الراديوم في عام 1910م.
– منذ اكتشافه، أطلق على الراديوم عدة أسماء مثل الراديـوم A والراديـوم C2 والعديد من العناصر نتائج اضمحلال الراديـوم.
– الراديوم هو العضو المشع الوحيد في معادن الأرض القلوية، وهو أيضًا العنصر الأكثر ندرة في هذه المجموعة، ويتشكل بكميات صغيرة عندما تتحلل ذرات المعادن الأكثر شيوعًا – مثل اليورانيوم والثوريوم.
– علاوة على ذلك لا تدوم ذرات (Ra) لفترة طويلة، حيث يتحلل معظمها سريعًا إلى غاز الرادون، وهو غاز نبيل مشع.
– في الطبيعة، تم العثور على (Ra) في خامات اليورانيوم بكميات ضئيلة، على الأقل يتم العثور على 0.7 جم للطن الواحد من خام اليورانينايت Uraninite
طرق تحضير الراديوم Preparation of Radium
(1) من الانحلال الإشعاعي لليورانيوم
– يتكون عنصر الراديوم، بشكل دائم في الطبيعة نتيجة للانحلال الإشعاعي لليورانيوم.
– فأثناء حدوث هذه الظاهرة، يبث اليورانيوم 238، وهو أثقل نظير إشعاعي لليورانيوم، الإشعاع في شكل جسيمات ألفا، وجسيمات بيتا، وأشعة جاما.
– ويتحول اليورانيوم 238، إلى اليورانيوم 234، والذي يتحول بدوره فيما بعد، إلى الثوريوم 230، وينحل هذا النظير الإشعاعي غير المستقر بدوره إلى الراديوم-226
(2) استخلاص معدن الراديوم من كلوريد الراديوم الرطب
– ينقى الراديوم بالبلورة الجزئية من حامض الهيدروكلوريك المائي.
– يجفف RaCl2 وينقى بالبلورة.
– تستخدم بلورات RaCl2 النقية ويستخدم القوس الكهربي في التحليل لعزل العنصر المعدني بالتحليل الكهربائي كما بالمعادلات الآتية:
القطب السالب:
Ra2+ + 2e → Ra
القطب الموجب:
–Cl2-(g) → 1/2Cl2 + 2e
– التحليل الكهربائي يحل كلوريد الراديـوم الصافي.
– باستخدام قطب زئبق سالب بملغم الراديـوم بالزئبق بالتحليل الكهربائي بالتقطير في جو من الهيدروجين.
– يزال الزئبق بالتقطير، وينتج معدن الراديـوم الصافي.
مركبات الراديوم
– مركباته جداً مشابهة لمركبات الباريوم إلى حد المطابقة، حتى يصعب العمل على التفريق بين العنصرين.
– الشكل التجاري للراديوم هو أنه يباع على شكل:
- بروميد الراديـوم RaBr2
- كلوريد الراديـوم RaCl2
– كما تلون مركباتها النيران بلون قرمزي وتعطي الطيف المميز للراديـوم.
مركب ثاني كلوريد الراديوم RaCl2
– هو أول مركب راديوم يعزل في صورة نقية، استخدمته ماري كوري عند فصلها للراديـوم عن الباريوم.
– أول فصل لمعدن (Ra) كان عن طريق التحليل الكهربائي لمحلول من كلوريد الراديـوم باستخدام كاثود من الزئبق.
– يتم تحضير ثاني كلوريد الراديـوم عن طريق تسخين بروميد الراديـوم في تيار من كلوريد الهيدروجين الجاف، أو عن طريق تجفيف كبريتات الراديـوم بالهواء الجاف، ثم تسخين الكبريتات في تيار من كلوريد الهيدروجين.
– ثاني كلوريد الراديـوم مادة صلبة بيضاء عديمة اللون لها بريق أخضر ذو زرقة خاصة عند تسخينه، يتغير لون كلوريد الراديـوم تدريجيًا مع القِدم إلى الأصفر.
– مازال كلوريد الراديـوم يستخدم في المراحل الأولية لفصل (Ra) عن الباريوم خلال استخراج (Ra) من البيتشبلند، ورغم كميات المواد الضخمة المتعلقة بهذه العملية (أطنان من الخام لميليجرامات من الراديوم)، تفضل هذه الطريقة الأقل تكلفة (ولكنها الأقل فعالية) على الطرق القائمة على استخدام بروميد الراديـوم أو كرومات الراديـوم (التي تستخدم لمراحل لاحقة من عملية الفصل).
الخواص الكيميائية لعنصر الراديوم Chemical properties of Radium
(1) التفاعل مع الهواء
يمكن للراديوم أن يحترق في الهواء مشكلاً مزيج من أكسيد الراديـوم الأبيض RaO2، نتريد الراديـوم Ra3N2 كما بالتفاعلات التالية:
2Ra(s) + O2(g) → 2RaO(s)
Ra(s) + O2(g) → RaO2(s)
3Ra(s) + N2(g) → 2Ra3N2(s)
(2) التفاعل مع الماء
الراديوم يتفاعل بسهولة مع الماء لتكوين هيدروكسيد الراديـوم وغاز الهيدروجين كما بالتفاعل التالي:
Ra(s) + 2H2O(g) → Ra(OH)2 (aq) + H2(g)
استخدامات الراديوم Uses of Radium
(1) تؤثر إشعاعات الراديوم على الأفلام الفوتوغرافية حتى لو عزلت بأوراق غير منفذة، كما أن لها القدرة على اختراق الخشب والصفائح الفلزية الرقيقة.
(2) علاوة على ذلك فأن للراديوم ومركباته القدرة على إزالة شحنة الكشاف الكهربائي، والتأثير على عداد غايغر، فهو يؤين جزيئات الهواء بالقرب من قرص الكشاف.
(3) لمركبات الراديـوم القدرة على التوهج عند خلطها مع غيرها من المركبات، فمثلاً عند خلط كمية قليلة من بروميد الراديـوم وكبريتيد الزنك يتكون خليط يتوهج في الظلام كما تتوهج عقارب الساعة في الظلام.
(4) يستخدم في صناعة الدهانات المضيئة كما في أقراص الساعات watch dials حيث يجعل طلاء (Ra) الأرقام تتوهج باللون الأخضر والأزرق في الظلام كما في الصورة التالية حيث أنه في غضون 100 عام، فقد تحطم 4٪ فقط من ذرات (Ra) في هذه الساعة. وغالبًا ما يصاب الأشخاص الذين يعملون بهذا الطلاء بالمرض، خاصةً مع السرطان، لأن الإشعاع الناتج عن الراديـوم يضر بالحمض النووي DNA
هذا العنصر خطير للغاية ونادرًا ما يستخدم اليوم. ومع ذلك، في أوائل القرن العشرين، كانت مركبات الراديـوم شائعة الاستخدام.
(1) تم استخدامه في أوائل القرن العشرين في صنع آلة تسمى Radium emanator. وهي خلطت الراديـوم بالماء، والذي كان يعتقد أنه يجعل شربه أكثر صحة.
(2) في القرن العشرين كان يعتقد أن الكريمات ومستحضرات التجميل التي تحتوي على (Ra) تجعل البشرة أكثر صحة، على الرغم من أنهم فعلوا العكس تمامًا حيث كان غسول البشرة Skin lotions المحتوي على (Ra) شائع حينذاك وكان يُعتقد أن مسحوق الراديـوم للوجه Radium face powder مفيد للبشرة.
(3) ومع ذلك، حتى الأربعينيات من القرن الماضي، اعتقد الكثير من الناس أن النشاط الإشعاعي للراديـوم يجعلهم أقوى وليس أضعف حيث قاموا بحقن أنفسهم بقوارير تحتوي على مركب (Ra) ، معتقدين أنه يمنحهم دفعة من الطاقة.
تأثير الراديوم على جسم الإنسان
– الإشعاع الناتج عن الراديوم يضر بالحمض النووي DNA للإنسان.
– بالإضافة إلى ذلك تسبب أشعة (Ra) حروقاً على جلد من يعملون به تحتاج لفترة طويلة في الشفاء.
– يستخدم لعلاج أمراض الجلد والسرطان وهذا راجع إلى قدرته على الإضرار بأنسجة جسم الإنسان.
تأثير الراديوم على البيئة
– لأشعة الراديوم القدرة على قتل أجنة البذور والبكتيريا وحتى الحيوانات الصغيرة.
– الراديوم ليس ضروريًا للكائنات الحية، ولكن تصبح له أضرار عندما يتم دمجه في العمليات البيوكيميائية (الكيميائية الحيوية) بسبب نشاطه الاشعاعي وتفاعلاته الكيميائية.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري. / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.